Kysličník uhelnatý
| Strukturní vzorec | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
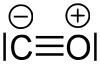
| ||||||||||||||||||||||
| Všeobecné | ||||||||||||||||||||||
| Příjmení | Kysličník uhelnatý | |||||||||||||||||||||
| ostatní jména |
|
|||||||||||||||||||||
| Molekulární vzorec | CO | |||||||||||||||||||||
| Stručný popis |
plyn bez barvy a zápachu |
|||||||||||||||||||||
| Externí identifikátory / databáze | ||||||||||||||||||||||
| ||||||||||||||||||||||
| vlastnosti | ||||||||||||||||||||||
| Molární hmotnost | 28,01 g mol −1 | |||||||||||||||||||||
| Fyzický stav |
plynný |
|||||||||||||||||||||
| hustota |
1,25 kg m −3 (0 ° C, 1013 mbar) |
|||||||||||||||||||||
| Bod tání |
-205,07 ° C |
|||||||||||||||||||||
| bod varu |
-191,5 ° C |
|||||||||||||||||||||
| rozpustnost |
30 mg l -1 ve vodě (20 ° C) |
|||||||||||||||||||||
| Dipólový moment | ||||||||||||||||||||||
| bezpečnostní instrukce | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
DFG / Švýcarsko: 30 ml m −3 nebo 35 mg m −3 |
|||||||||||||||||||||
| Toxikologická data | ||||||||||||||||||||||
| Termodynamické vlastnosti | ||||||||||||||||||||||
| ΔH f 0 | ||||||||||||||||||||||
| Pokud je to možné a obvyklé, používají se jednotky SI . Pokud není uvedeno jinak, uvedené údaje platí pro standardní podmínky . | ||||||||||||||||||||||
Oxid uhelnatý (technický jazyk oxid uhelnatý , obvykle oxid uhelnatý ) je chemická sloučenina z uhlíku a kyslíku s sumárního vzorce CO. Oxid uhelnatý je plyn bez barvy, zápachu, chuti a jedu . Vzniká mimo jiné z neúplného spalování uhlíkatých látek s nedostatečným přísunem kyslíku. Formálně plyn je anhydrid kyseliny z kyseliny mravenčí , ale sotva se rozpouští ve vodě.
Oxid uhelnatý je hořlavý a hoří s kyslíkem v modrém, průhledném plameni za vzniku oxidu uhličitého . Je velmi reaktivní při zvýšených teplotách a reaguje s různými přechodnými kovy za vzniku kovových karbonylů . Oxid uhelnatý reaguje se sírou za vzniku karbonylsulfidu , s alkalickými hydroxidy až mravenčany a halogeny, jako je fluor nebo chlor, že reaguje za vzniku karbonylu halogenidy, jako je karbonyl fluorid nebo fosgenem . Oxid uhelnatý reaguje s azosloučeninami za vzniku izokyanátů a s amoniakem za vzniku toxického formamidu . Jako složka syntézního plynu reaguje při syntéze Fischer-Tropsch za vzniku různých uhlovodíků a jejich oxidačních produktů . Používá se také pro syntézu methanolu a isobutanolu . Jako součást městského plynu se v Německu používal jako palivo a osvětlovací plyn až do druhé poloviny 20. století .
Plyn je jedovatý, protože se váže na hemoglobin silněji než kyslík a brání tak přenosu kyslíku krví. Otrava oxidem uhelnatým , je často součástí procesu kouřem a onemocnění dolu po inhalaci toxických plynů v hornictví ; během krátké doby to může být smrtelné.
nomenklatura
Ve stažené německé normě DIN 32640 „Chemické prvky a jednoduché anorganické sloučeniny - názvy a symboly“ z prosince 1986 se doporučuje hláskování „oxid uhelnatý“ s „oo“, protože podle pravidel IUPAC pro nomenklaturu anorganické chemie končí nelze vynechat samohlásky řeckých číslic s předponou.
Naproti tomu ve vydání nomenklatury IUPAC z roku 1990 se používá hláskování „oxid uhelnatý“. O používání multiplikativních předpon říká: „Konečné samohlásky multiplikativních předpon nejsou opomenuty, ledaže existují pádné jazykové důvody. Monoxid je jednou z takových výjimek. “
příběh
Již v roce 1000 před naším letopočtem Chr. Byl použit při tavení kovových rud , přičemž byl použit redukční účinek oxidu uhelnatého v takzvaném Rennöfenu , ale bez znalosti povahy plynu. Řekové a Římané jej používali k popravám . Na konci 13. století popsal Arnaldus de Villanova toxicitu plynu produkovaného spalováním dřeva; myslel se tím oxid uhelnatý. Na počátku 17. století experimentoval Johan Baptista van Helmont s plynem nazývaným gas carbonum , směsí oxidu uhličitého a oxidu uhelnatého.
V roce 1776, francouzský chemik Joseph de Lassone vyrábí oxid uhelnatý zahříváním oxidu zinečnatého s koksem . Omylem předpokládal, že jde o vodík. Joseph Priestley vyrobil v roce 1799 oxid uhelnatý procházením oxidu uhličitého přes horké železo. William Cruickshank použil stejný postup v roce 1800. Navrhl správné složení CO. Toxické vlastnosti na psech studoval Claude Bernard kolem roku 1846.
Na počátku 19. století vzrostla poptávka po světelných plynech . Anglický uhelný průmysl začal v této době vyvíjet procesy pro zplyňování uhlí . S rozvojem vysokotlakých procesů v chemickém průmyslu na počátku 20. století prudce stoupla poptávka po syntézních plynech obsahujících oxid uhelnatý . Velkého rozsahu zplyňování uhlí bylo dosaženo vývojem generátoru Winkler , tlakového zplyňovače Lurgi a později reaktoru Koppers-Totzek .
Během nacistické éry byl oxid uhelnatý používán k popravám. V akci T4 bylo v letech 1940 až 1945 v Německu systematicky zavražděno oxidem uhelnatým více než 70 000 lidí s mentálním a fyzickým postižením.
Výskyt
Atmosférické výskyty
Průměrná koncentrace oxidu uhelnatého v zemské atmosféře je přibližně 90 miliardtin objemové frakce (anglický výraz pro miliardtinu je část na miliardu ; s přidáním „v“ pro objemovou frakci se tato pomocná jednotka obvykle zkracuje na „ppbv“ "). Atmosféra obsahuje celkem kolem 400 megatun (Mt). Na severní polokouli je dnes průměrná koncentrace 140 ppbv, před industrializací to bylo kolem 90 ppbv. Na jižní polokouli zůstala průměrná koncentrace na její přirozené úrovni 50 ppbv.
Satelitní přístroj Terra's Measurements of Pollution In The Troposphere (MOPITT) vytvořil první globální mapu pro koncentraci CO v atmosféře spodní země. Připojený obrázek MOPITT ukazuje průměrnou koncentraci CO od dubna, května a června za roky 2000 až 2004.
Oxid uhelnatý má průměrnou životnost v atmosféře přibližně dva měsíce. Nejdůležitější reakcí je, že s hydroxylovými radikály v atmosféře, které ročně oxidují 2300 Mt (2000–2800 Mt) oxidu uhelnatého na oxid uhličitý. Půdy přispívají k oxidaci CO ročně přibližně 300 Mt (200–600 Mt). Rychlost oxidace závisí na koncentraci hydroxylových radikálů, která se zvyšuje se silnějším slunečním zářením a vyšším obsahem vodní páry. V tropech je životnost asi měsíc, v mírných a severních zeměpisných šířkách se pohybuje od dvou měsíců v létě do více než roku v zimě. K vyvážení koncentrací oxidu uhelnatého mezi severní a jižní polokoulí by byla zapotřebí průměrná životnost atmosféry přibližně jeden rok. Vyšší antropogenní emise na severní polokouli proto vedou k významnému rozdílu v koncentraci mezi polokoulemi. Vzhledem k povětrnostním vlivům, jako je indický monzun a emise z metropolitních oblastí, existují regionálně značné rozdíly v koncentraci , například ve východní Asii .
Celosvětově se do atmosféry uvolňuje nebo se zde tvoří přibližně 2 500 megatonů (2 000–2 900 Mt) oxidu uhelnatého. Přibližně polovina z toho je způsobena neúplným spalováním fosilních paliv nebo biomasy , včetně lesních a keřových požárů. Další velká část se tvoří pouze v atmosféře oxidací uhlovodíků, jako je metan nebo jiné těkavé organické sloučeniny . Celkově je asi 60% oxidu uhelnatého způsobeno lidmi, zbytek je přírodního původu.
Informace o globálních emisních sazbách jsou založeny na odhadech a podléhají faktorům nejistoty. Emise oxidu uhelnatého z provozu jsou udávány jako 500 Mt (300–600 Mt), stacionární systémy pro výrobu energie z fosilních paliv emitují 100 Mt (80–200 Mt), spalování biomasy 600 Mt (300–800 Mt). Oxidace metanu produkuje 600 Mt (400–800 Mt), rozklad ostatních těkavých organických sloučenin 500 Mt (300–700 Mt). Jiné biogenní zdroje uvolňují kolem 200 Mt (100–400 Mt), půdy kolem 30 Mt a oceány kolem 10 Mt ročně.
Půdy mohou být jak zdrojem, tak jímkou oxidu uhelnatého. V suchých oblastech půdy uvolňují oxid uhelnatý, pravděpodobně prostřednictvím abiotického rozkladu organické hmoty pod vlivem světla a vysokých teplot. Mimo suché oblasti převládá degradace prokaryoty v závislosti na obsahu kyslíku a vody v půdě, a to buď redukcí na metan (činidlo tvořící metan ), nebo oxidací na oxid uhličitý.
Oceány jsou přesycené oxidem uhelnatým . V Atlantickém oceánu je koncentrace asi desetkrát až čtyřicetkrát vyšší než rovnovážná koncentrace v atmosféře, přičemž se předpokládá, že za to mohou biologické zdroje. Oceány jsou tedy zdrojem atmosférického oxidu uhelnatého, jehož podíl se odhaduje na 5 až 29% množství uvolněného spalováním.
Koncentrace 3700 ppm ( dílů na milion ), oxid uhelnatý se měří v plynech z havajských sopek . Sopky nehrají v globální rovnováze žádnou roli.
Hlavní Infračervené absorpční pás oxidu uhelnatého je při vlnočtu z 2.143 cm -1 ( vlnová délka asi 4,67 um ), a tedy od spektrálního maxima zemské infračerveného záření , které je při vlnočtu asi 1000 cm -1 (10 µm). Oxid uhelnatý proto přispívá malou přímou absorpcí ke skleníkovému efektu . V troposféře probíhá oxidace uhlovodíků, jako je metan, na oxid uhličitý také prostřednictvím hydroxylových radikálů. Oxidace metanu také produkuje oxid uhelnatý jako meziprodukt. Účinek oxidu uhelnatého s ohledem na skleníkový efekt spočívá v jeho důležitosti jako jímače těchto hydroxylových radikálů, které proto již nejsou k dispozici pro konverzi přímých skleníkových plynů , jako je metan. Také methanol , metan podle druhého nejhojnějšího organického plynu v atmosféře, který se vyskytuje v koncentracích 0,1 až 10 ppbv , je významným atmosférickým zdrojem oxidu uhelnatého, kde hlavní část methanolu je emitována z rostlin.
V městském prostředí mohou mít neupravené výfukové plyny automobilů hodnoty mezi 100 a 200 ppm. Koncentrace oxidu uhelnatého v neředěné výfukových plynů k automobilu bez katalyzátoru je asi 7000 ppm. Ve vozidlech s třícestným katalyzátorem a správně nastaveným řízením lambda sondy se oxid uhelnatý ideálně používá ke snížení oxidů dusíku , přičemž se sám oxiduje na oxid uhličitý. Kvůli vysokým teplotám výfukových plynů a s tím související úpravou Boudouardovy rovnováhy obsahují výfukové plyny z osobních automobilů s benzínovými motory vždy určité množství oxidu uhelnatého. Mezní hodnota 1000 ppm je uvedeno v emisní normy Euro 5 a 6 , pro vozidla s dieselovými motory mezní hodnota je 500 ppm. Ve Spojených státech více než polovina troposférických emisí oxidu uhelnatého v roce 2002 pocházela z provozu vozidel, asi 61 ze 117 milionů tun. V metropolitních oblastech byly výfuky vozidel zodpovědné za přibližně 75% všech emisí oxidu uhelnatého. Emise oxidu uhelnatého z těchto mobilních zdrojů od počátku 90. let 20. století klesaly přibližně o 5%.
Oxid uhelnatý, oxidy dusíku a těkavé uhlovodíkové sloučeniny jsou prekurzorovými molekulami pro tvorbu ozónu (O 3 ) v troposféře. Tvorba ozónu probíhá oxidací oxidu dusnatého (NO) na oxid dusičitý (NO 2 ) peroxy radikály , které vznikají například při oxidaci oxidu uhelnatého. Ty velmi rychle reagují se stávajícím oxidem dusičitým za vzniku oxidu dusičitého. Ozon je vytvořen pomocí fotolýzy oxidu dusičitého.
Distribuce, zdroje a propady oxidu uhelnatého se mezi troposférou a stratosférou liší . Ve stratosféře jaderné reakce nepřetržitě vytvářejí izotop uhlíku 14 C , například když izotop dusíku 14 N, který je zdaleka nejběžnějším izotopem dusíku , je zasažen neutronem. Je-li neutron zachycen a proton odštěpí se 14 N jádro se stává 14 C jádro. Výsledný uhlík se nejprve oxiduje na oxid uhelnatý. Doba setrvání oxidu uhelnatého ve stratosféře závisí mimo jiné na koncentraci hydroxylových radikálů , kterými je oxidován na oxid uhličitý.
Výskyt v budovách
V obytných budovách je normální koncentrace 0,5 až 5 ppm, přičemž koncentrace až 15 ppm v blízkosti plynových hořáků . Oxid uhelnatý má hustotu 96,5% hustoty vzduchu , je tedy o něco lehčí. Pokud je komínový tah dostatečný , vzniká oxid uhelnatý, který rychle stoupá teplým výfukovým plynem komínem, pokud je uhlík neúplně spálen. Pokud je z kamna na dřevo špatný tah komína , může se oxid uhelnatý dostat do vzduchu v místnosti a vést k otravě. Existuje mnoho důvodů pro zpětný tok výfukových plynů nebo jeho nedostatečné odstranění. Například vítr, zastaralé nebo špatně seřízené a udržované kotle, zapnutá digestoř nebo zapnutý systém centrálního vysavače mohou způsobit protitlak, který může vést k zpětnému toku spalin. Děravé komíny a kamna, nesprávně dimenzované komíny nebo například komíny ucpané vosami nebo ptačí hnízdem mohou zabránit odsávání dostatečných výfukových plynů. Jiné zdroje oxidu uhelnatého v obytných místnostech jsou grilování na dřevěném uhlí, dřevo požáry, nebo provoz zářičů vyhozen s propanem . Kohlenstoffmonoxidquellen mohou být také plynová kamna , emise z dřevěných pelet v bunkrech na pelety, výfukové plyny z připojených garáží a použití provzdušňovacích zařízení a generátorů poháněných spalovacími motory .
Tabákový kouř obsahuje značné množství oxidu uhelnatého. Deset uzených cigaret zvyšuje koncentraci asi 22 ppm oxidu uhelnatého v nevětrané místnosti o objemu 30 m³.
Mimozemské výskyty
Oxid uhelnatý je také rozšířený v mimozemském prostoru, mimo Zemi a její atmosféru. Vzniká tam, když mnohem vzácnější oxid uhličitý reaguje s atomovým a molekulárním vodíkem za vzniku vody a oxidu uhelnatého. Existuje také řada dalších reakcí tvorby, například reakce uhlíkových kationtů s hydroxylovými radikály za vzniku oxidu uhelnatého a protonu .
Oxid uhelnatý je zjištěna v photosphere na Slunce a atmosférách Venuše , Mars , Jupiter , Saturn , Titan , Uran a Neptun . Koncentrace oxidu uhelnatého v atmosféře Venuše je asi 50 ppm, v atmosféře Marsu bylo naměřeno 700 ppm. Ve vnější sluneční soustavě je oxid uhelnatý druhou nejhojnější složkou v extrémně tenké atmosféře trpasličí planety Pluto . Oxid uhelnatý byl také detekován v atmosféře exoplanet .
Giotto sonda měří 10% oxidu uhelnatého v plynné emise z komety Halley . Oxid uhelnatý byl také detekován v emisích jiných komet, jako jsou Hyakutake , Hale-Bopp a Schwassmann-Wachmann 1 . Tato pozorování vedla k závěru, že oxid uhelnatý byl hlavním zdrojem uhlíku při formování sluneční soustavy. V prehistorických dobách sluneční soustavy vznikaly z oxidu uhelnatého a vodíku složitější organické molekuly, jako jsou uhlovodíky a mastné kyseliny, reakcemi typu Fischer-Tropsch , které mohou souviset se vznikem života.
Důležitá emisní linie mezihvězdného oxidu uhelnatého vyskytující se v molekulárních mracích je na vlnové délce 2,6 mm a je většinou buzena srážkami s molekulami vodíku. Infračervené a rádiové pozorování oxidu uhelnatého v molekulárních oblacích se proto používá k nepřímému stanovení mezihvězdné koncentrace vodíku. Předpokládá se, že poměr oxidu uhelnatého a vodíku je konstantní. Rotační přechody oxidu uhelnatého jsou účinným mechanismem pro přeměnu tepelné energie na mikrovlnné a infračervené záření a jsou jedním z důležitých chladicích mechanismů molekulárních mraků. Tyto energetické ztráty usnadňují podmínky pro výskyt gravitačního kolapsu molekulárního mraku v dostatečně hustých oblastech molekulárního mraku, což může vést ke vzniku hvězd . Jako indikátor přítomnosti vodíku je oxid uhelnatý jednou z nejvíce studovaných mezihvězdných molekul. Měřením červeného posunu rotačních přechodů oxidu uhelnatého bylo možné určit jeho distribuci a kinematiku v galaktické rovníkové rovině .
Extrakce a prezentace
Oxid uhelnatý lze získat z mnoha uhlíkatých surovin, jako je např B. Lze vyrábět zemní plyn , bioplyn , lehký benzín , těžké oleje , uhlí nebo biomasu . Pokud je surovinou uhlí nebo koks, první generátorový plyn (obsahuje kromě N 2 asi 25% CO ), vodní plyn (CO: H 2 asi 1: 1) nebo syntetický plyn (CO: H 2 asi 1: 2) je generován, který je vyčištěn a zpracován. Metan jako surovina vede k krakovanému plynu (CO: H 2 přibližně 1: 3). Nejdůležitějšími průmyslovými procesy jsou zplyňování uhlí , reformování párou a částečná oxidace uhlovodíků.
Zplyňování uhlí
Zplyňování uhlí probíhá v takzvaných generátorech, které mohou v závislosti na řízení procesu produkovat generátorový plyn, vodní plyn nebo syntézní plyn. Typy použitých generátorů jsou různorodé a liší se mimo jiné typem přivádění uhlí, odstraňováním strusky a použitým uhlím a velikostí zrn . Kromě na čepování generátoru , na pevném roštu generátoru a otočného roštu generátoru je Winkler generátor se tlak zplyňovač Lurgi a reaktor Koppers-Totzek jsou použity , tyto tři zmíněné hlavně používá pro výrobu syntézního plynu. Kromě plynů se v doutnajících generátorech získává také dehet a plyny obohacené uhlovodíky.
Výroba vody a syntézního plynu
Koks se zplyňuje při zvýšené teplotě jeho reakcí s vodní párou a vzduchem nebo výhodně s kyslíkem. Složení plynu lze určit procesním managementem. Při střídání vzduchu (perioda bublin nebo jednoduše „bublin“) a vodní páry (perioda plynu nebo „plyny“) vzniká vodní plyn, přičemž se používá pouze plyn generovaný během reakce s vodní párou. Provoz se vzduchem slouží k vyfukování koksu za horka do žhavení , čímž poskytuje potřebnou energii pro endotermickou reakci plyn -voda. Pokud jsou generátory provozovány nepřetržitě se vzduchem nebo kyslíkem a vodou, je hlavním produktem syntetický plyn.
Změna energetického obsahu systému, entalpie , je vyjádřena symbolem , přičemž endotermické reakce mají podle konvence kladné znaménko. Exponent nula znamená standardní podmínky (100 kPa a 25 ° C). Zatímco entalpie udává, zda je proces je exotermní nebo endotermní, změna v Gibbsovy energie v průběhu chemické reakce, je rozhodujícím kritériem pro zda konverze látek, kterých skutečně probíhá dobrovolně.
Hlavní reakcí je endotermická heterogenní reakce vodního plynu:
To je spojeno s exotermickým spalováním uhlíku:
S tím souvisí i další reakce. Nejdůležitější jsou Boudouardova rovnováha
a homogenní reakce vodního plynu (reakce posunu vodního plynu )
Výroba generátoru plynu
Generátorový plyn vzniká neúplným spalováním koksu. K tomu je vzduch veden vrstvou uhlíku a zpočátku spálen na přebytečný vzduch na oxid uhličitý. Oxid uhličitý poté reaguje s uhlíkem za vzniku oxidu uhelnatého při vysokých teplotách. Generátorový plyn má složení asi 70% dusíku, 25% oxidu uhelnatého a 4% oxidu uhličitého. Plyn také obsahuje vodík, metan a kyslík.
Parní reforma
Oxid uhelnatý může být připravena působením na zemní plyn nebo lehký ropy se vyrábějí s vodní páry frakce, například z methanu od
nebo obecně po
Hlavním produktem reformy páry je vodík. Endotermická reakce probíhá v přítomnosti niklových katalyzátorů při teplotách od 700 do 1100 ° C. Reakce je reverzibilní .
Částečná oxidace uhlovodíků
Při částečné oxidaci se výchozí materiál, například těžký topný olej, oxiduje omezeným množstvím kyslíku za vzniku vodíku a oxidu uhelnatého. Rozlišuje se mezi tepelnou a katalytickou částečnou oxidací. V případě částečné tepelné oxidace je reakční teplota kolem 1200 ° C, v katalytických procesech, v závislosti na katalyzátoru, kolem 800 až 900 ° C:
Laboratorní váha

V laboratoři lze ustálený proud oxidu uhelnatého vytvářet kapáním kyseliny mravenčí do teplé koncentrované kyseliny sírové nebo fosforečné :
Protože je oxid uhelnatý velmi toxický, musí být přebytečné množství shromažďováno pomocí speciálních absorbérů nebo pomocí plamenového zařízení. Zvláštní opatrnosti je třeba u směsí oxidu uhelnatého a vzduchu, protože tyto mohou reagovat výbušně . Je také možné katalyticky převádět oxid uhelnatý oxidem měďnatým nebo hopkalitem na oxid uhličitý.
Separace oxidu uhelnatého
Pokud jsou jako produkt požadovány čisté plyny, musí být výše popsaná plynná směs oddělena. Pro mnoho aplikací je naopak přímo vyžadován syntézní plyn; zde se musí podle potřeby upravit pouze poměr mezi oxidem uhelnatým a vodíkem. Oxid uhelnatý lze oddělit následujícími způsoby:
- Reverzibilní komplexace se solemi mědi a hliníku za zvýšeného tlaku; za sníženého tlaku se oxid uhelnatý opět uvolňuje.
- Kondenzace při nízkých teplotách
- Adsorpce kolísání tlaku
- Polopropustné membrány
vlastnosti
Fyzikální vlastnosti
Oxid uhelnatý je plyn bez barvy a zápachu s molární hmotností 28,01 g / mol. Při 1,25 kg / m³ má téměř stejnou hustotu jako vzduch. Teplota varu −191 ° C a teplota tání −205 ° C se blíží hodnotám izoelektronického (viz níže) dusíku, který má teplotu varu –196 ° C a teplotu tání –210 ° C.
Trojný bod , ve kterém se tři fáze pevné, kapalné a plynné jsou v rovnováze , je při teplotě -205,0 ° C a tlaku 0,154 MPa . Kritická teplota je -140,2 ° C, kritický tlak je 35,0 bar, kritická hustota je 0,301 g / cm.
Po ochlazení oxid uhelnatý zpočátku tvoří pevnou, neuspořádanou, hexagonální β-fázi, která se při ochlazení dále pod 61,6 K mění na uspořádanou α-fázi, která v systému krychlových krystalů má prostorovou skupinu P 2 1 3 (prostor skupina č. 198) krystalizuje. Při vysokých tlacích přes 52 000 barů se tvoří pevné, bělavé, nažloutlé nebo červené, metastabilní polykarbonylové fáze, jejichž přesná struktura je stále neznámá.
Uhlík a kyslík jsou v molekule oxidu uhelnatého k sobě velmi pevně vázány. Disociační energie je o něco vyšší, než je velmi inertní dusného molekuly , která je isoelectronic na oxid uhelnatý , a je 1070,3 kJ / mol. K rozdělení molekuly dusíku N 2 je zapotřebí pouze 946 kJ / mol.
Hmotnostní výhřevnost je 10,1 MJ / kg, což je přibližně 5krát méně než u metanu. Objemová výhřevnost a spalná teplo je 12 636 kJ / m³, a proto se pohybuje v rozmezí vodíku. Teplota vznícení je 605 ° C. Rozsah vznícení je od 12,5 do 75 % objemových oxidu uhelnatého ve vzduchu.
Molekulární vlastnosti
Délka vazby mezi atomy uhlíku a kyslíku je 106 pm v pevné fázi a 112,8 pm v plynné fázi. Vzdálenost mezi dvěma danými atomy je asi o 20 pm menší, pokud jsou spojeny dvojnou vazbou místo jednoduché vazby .
U trojné vazby je vzdálenost o dalších 10 hodin menší než u dvojné vazby. Vazba uhlík-kyslík , která je asi o 10 μm kratší než dvojná vazba uhlík-kyslík organické karbonylové sloučeniny , například v případě formaldehydu , tedy naznačuje trojnou vazbu.
Molekulární struktura je nejlépe popsána pomocí molekulární orbitální teorie . Podle jejich pravidel je počet výsledných molekulárních orbitálů roven počtu zúčastněných atomových orbitálů . Osm molekulárních orbitálů oxidu uhelnatého je vytvořeno ze čtyř atomových orbitálů uhlíku a kyslíku. Obsazený molekulární okružní z nejvyšší energie (HOMO) formuje antivazebných σ y * orbitalu. U antibondických orbitálů není nejvyšší pravděpodobnost lokalizace elektronů mezi zahrnutými atomovými jádry. V důsledku toho není odpuzování kladně nabitých atomových jader stíněno. Molekulárním orbitálům se proto říká antibonding. Tyto neobsazené molekulové orbitaly nejnižší energií (LUMO) jsou antivazebných π x, y * orbitaly.
V základním stavu je molekula v singletovém stavu , což znamená, že v molekule nejsou žádné nepárové elektrony. V Lewisově strukturním vzorci se na atomu kyslíku vyskytuje kladný formální náboj a na atomu uhlíku negativní formální náboj:
Vzhledem k vysokému rozdílu elektronegativity 1 mezi vazebnými partnery je tento formální náboj opět vyrovnaný a oxid uhelnatý je tedy téměř nepolární. Jeho dipólový moment je pouze μ = 0,10980 D , přičemž dipólový moment je směrován tak, že atom kyslíku nese kladný náboj.
Chemické vlastnosti
Tvorba oxidu uhelnatého z prvků je exotermická a je v disproporcionální rovnováze s uhlíkem a oxidem uhličitým. Protože je tato rovnováha při pokojové teplotě téměř neměřitelně pomalá, lze oxid uhelnatý izolovat i přes nepříznivou rovnovážnou polohu - oxid uhelnatý je metastabilní . Při vyšších teplotách se rovnováha posouvá ve prospěch oxidu uhelnatého ( LeChatelierův princip ). Toho se využívá například při výrobě železa ve vysokopecním procesu, kde je plynný oxid uhelnatý mnohem účinnějším redukčním činidlem než tuhý koks . V průmyslových procesech může oxid uhelnatý otrávit katalyzátory, protože se silně váže na aktivní centra kovů, jako jsou atomy niklu nebo železa, a blokuje je pro další reaktanty.
Oxid uhelnatý je dobrým a levným redukčním činidlem a používá se v této funkci různými způsoby. Oxidační síla je však pouze slabá. V organokovové chemii je oxid uhelnatý monodentátový ligand, který se často používá , a chemie kovových karbonylů byla dobře prozkoumána. Je to jeden ze silných polních ligandů a je izoelektronický vůči dusíku (N 2 ) i vůči kyanidovým iontům (CN - ) a nitrosylu (NO + ). Silná vazba kov-ligand je vytvořena vývojem synergicky posilujících vazeb tam a zpět . Oxid uhelnatý je silným dárcem σ a π akceptorem . Migruje v alkyl-kovových vazbách komplexů za vzniku acylových skupin .
S aromáty, jako je benzen , oxid uhelnatý reaguje s chlorem s chloridem hlinitým nebo chloridem měďnatým v Gattermannově-Kochově reakci za vzniku benzaldehydu . Oxid uhelnatý reaguje se silnými redukčními činidly, jako je kovový draslík, za vzniku draselné soli hexahydroxybenzenu nebo draselné soli dihydroxyacetylenu .
použití
Oxid uhelnatý se často používá v chemickém průmyslu společně s vodíkem jako syntézním plynem . U některých aplikací je však také vyžadován čistý oxid uhelnatý, například pro výrobu kovových karbonylů, jako je tetrakarbonyl niklu nebo pentakarbonyl železa , pro karbonylace nebo výrobu kuchyňských kyselin . Výroba fosgenu , kyseliny octové a anhydridu kyseliny octové a výroba methylformiátu a kyseliny mravenčí také vyžadují čistý oxid uhelnatý.
Čistý oxid uhelnatý se získává hlavně ze syntézního plynu fyzikálními nebo chemickými separačními procesy. Fyzická separace probíhá částečnou kondenzací a následnou destilací podle Lindeova procesu nebo membránovou permeací . Tím, adsorpce s komplexní formaci, oxid uhelnatý může být oddělena od ostatních složek syntézního plynu pomocí mědi (I), solné roztoky.
Oxid uhelnatý používaný v chemickém průmyslu se většinou vyrábí na místě a dále se zpracovává interně. K dispozici je také možnost doručení tankerem nebo v plynových lahvích . Pro propojení chemických závodů je možná distribuce potrubím . Projekty na výstavbu těchto plynovodů, jako je Bayer AG CO potrubí , jsou často kritizovány, a může vést k zdlouhavé administrativní sporů.
Reakce syntézního plynu
Výroba methanolu
Methanol je základní organická chemická látka a alkohol ve velkém měřítku . Výroba z oxidu uhelnatého a vodíku probíhá podle následující hrubé rovnice:
V roce 2008 činila celosvětová spotřeba metanolu 45 milionů tun. Dnes se methanol vyrábí v průmyslovém měřítku ze syntézního plynu v procesu s nízkým nebo středním tlakem. Výsledný surový methanol je částečně kontaminován vedlejšími produkty. Pokud se surový methanol používá ke spalování v energetickém sektoru, je čistota surového methanolu dostačující. Pro další zpracování v chemickém průmyslu musí být methanol zpracován destilací. Nízkovroucí složky, jako je dimethylether, se oddělí v nízkovroucí koloně. Frakce s vyšším bodem varu se oddělí jako dna v dalším destilačním stupni ve vysokovroucí koloně, přičemž nahoře se odstraní methanol.
Fischerova-Tropschova syntéza
Při syntéze Fischer-Tropsch se směs oxidu uhelnatého a vodíku převádí pomocí heterogenní katalýzy . Katalyzátory jsou na bázi přechodných kovů kobaltu , železa , niklu a ruthenia ; jako nosiče se používají porézní oxidy kovů s velkými specifickými povrchy, jako je křemelina , oxid hlinitý , zeolity a oxid titaničitý .
Plynná směs se v reakční směsi převádí na uhlovodíky, jako jsou parafiny , olefiny a alkoholy. Konečnými produkty jsou benzín ( syntetický benzín ), nafta , topný olej a suroviny pro chemický průmysl. Reakce probíhá i za atmosférického tlaku a při teplotě 160 až 200 ° C; v závislosti na procesu se používají technicky vyšší tlaky a teploty. Syntéza probíhá podle následujícího reakčního schématu:
- ( Alkany )
- (n ≥ 2, alkeny )
- ( Alkoholy )
Každý kilogram paliva vyprodukuje zhruba 1,25 kilogramu vody, na jejíž výrobu se spotřebuje zhruba polovina vodíku. Typický výrobek společnosti Fischer-Tropsch obsahuje přibližně 10–15% kapalných plynů ( propan a butan ), 50% benzinu, 28% petroleje (motorová nafta), 6% měkkého parafínu (parafínový gáč) a 2% tvrdých parafinů. Tento proces je důležitý pro velkovýrobu benzínu a olejů z uhlí , zemního plynu nebo biomasy .
Hydroformylace
Spolu s vodíkem se oxid uhelnatý používá k hydroformylaci olefinů. Výslednými produkty jsou primárně aldehydy , většinou karbonylové hydridy kovů se používají jako katalyzátory v homogenních nebo heterogenních reakcích.
Technicky významným produktem hydroformylace s následnou hydrogenací je 2-ethylhexanol . Změkčovadlo di- n- oktylftalát může být vyrobeno z 2-ethylhexanolu a anhydridu kyseliny ftalové .
Reaguje s organickými molekulami a vodou
Kyselina mravenčí a deriváty
Čistý oxid uhelnatý se používá k výrobě kyseliny mravenčí z vody a methanolu ve stupni methylformátu . Jako katalyzátor se používá metoxid sodný . Methanol spotřebovaný v prvním kroku se ve druhém kroku opět uvolňuje hydrolýzou . První závod tohoto typu byl uveden do provozu v roce 1981 a vyráběl 100 000 tun ročně. V roce 2012 činila globální výrobní kapacita společnosti BASF při tomto procesu 255 000 tun ročně.
S hydroxidem sodným , se mravenčan sodný látky, která se používá jako surovina pro výrobu kyseliny šťavelové .
Zkoušky Monsanto a Tennessee Eastman
Reakcí oxidu uhelnatého s methanolem za použití směsných karbonylů rhodia se získá kyselina octová v procesu Monsanto . Ten se dále zpracovává na vinyl a acetát celulózy a meziprodukty pro chemický průmysl.
Anhydrid kyseliny octové je vytvořen prostřednictvím karbonylace z methylacetátu v procesu Tennessee Eastman .
Reppe chemie
Oxid uhelnatý se používá pro karbonylační reakce v organické syntéze. Reppe chemií se rozumí práce s acetylenem za zvýšeného tlaku, přičemž jako katalyzátory se používají kovové karbonyly a vodíkové karbonyly. Důležitou reakcí je hydrokarboxylace , při níž se používá acetylen s oxidem uhelnatým a vodou nebo alkoholem k výrobě kyseliny akrylové a esterů kyseliny akrylové:
Kyseliny na vaření
Terciární karboxylové kyseliny , takzvané Kochovy kyseliny, vznikají Kochovou reakcí oxidu uhelnatého s alkoholy nebo alkeny a vodou za kyselé katalýzy za vysokých tlaků a zvýšených teplot.
Chemický průmysl produkuje kolem 150 000 tun kuchyňských kyselin ročně. Některé Koch kyseliny, které jsou často vyráběny průmyslově jsou kyselina pivalová , kyselina 2,2-dimethylmáselné a kyselina 2,2-dimethylpentanová .
Kovové karbonyly
Oxid uhelnatý reaguje s přechodnými kovy za vzniku kovových karbonylů . Jedná se o komplexní sloučeniny, ve kterých oxid uhelnatý funguje jako ligand . Kovy se v těchto sloučeninách vyskytují s oxidačním číslem nula. Ludwig Mondovi se podařilo syntetizovat první homoleptický kovový karbonylový komplex, nikl -tetrakarbonyl , již v roce 1890. V následujících letech se mu podařilo syntetizovat řadu dalších kovových karbonylů, jako je pentacarbonyl železitý , dicobalt oktakarbonyl a hexakarbonyl molybdenu . V mnoha oblastech organokovové chemie používají chemici jako klíčové složky kovové karbonyly, například ke studiu chemických vazeb a cílené syntéze organokovových komplexů.
Kovové karbonyly se také používají v organické syntéze a jako katalyzátory nebo prekurzory katalyzátorů v chemickém průmyslu . Ligand oxidu uhelnatého může být nahrazen jinými, na míru šitými ligandy, jako je ve vodě rozpustný tris ( meta- sulfonatofenyl) fosfan sodný , a tak specificky přizpůsoben požadavkům technických postupů, jako je proces Ruhrchemie / Rhône-Poulenc .
Výroba fosgenu
Fosgen se vyrábí z oxidu uhelnatého a chloru za katalytického vlivu aktivního uhlí :
Fosgen je důležitým výchozím materiálem pro výrobu methylen diisokyanátů a toluen-2,4-diisokyanátu . Reaguje s dioly s polykondenzací za vzniku polykarbonátů .
Redukční činidlo
Ve vysoké peci slouží jako redukční činidlo pro železnou rudu podle hrubého vzorce:
Oxid uhelnatý se nepřidává jako plyn, ale vzniká ve vysoké peci ze spalování koksu a následné Boudouardovy reakce, jakož i z reakce horkého koksu s vodou, přičemž se uvolňuje oxid uhelnatý a vodík. Redukcí železných rud a oxidů železných společníků manganu , křemíku a fosforu se oxid uhelnatý oxiduje na oxid.
Redukované železo absorbuje uhlík z oxidu uhelnatého a stává se Fe 3 C, takzvaným cementitem , který způsobí pokles teploty tání z 1538 ° C na přibližně 1300 až 1400 ° C.
V horních pecích proti proudu vysokých pecí, které budou v komínu obsahovat plynný oxid uhelnatý, spalují:
Lunární proces a karbonylové železo
Proces měsíc používá oxid uhelnatý očistit kovový nikl s tvorbou a rozkladem tetrakarbonylniklu v chemické dopravní reakce . Proces vyvinul Ludwig Mond v roce 1890 . Způsob je vhodný pro výrobu čistého niklového kovu z oxidů niklu. V prvním kroku se oxidy redukují na kov vodíkem a poté se při 40 až 60 ° C oxidem uhelnatým převádějí na těkavý kov karbonylnikarbonethylkarbonyl . To lze oddestilovat z ostatních složek rudy. Při teplotách 150 až 300 ° C se karbonyl kovu opět rozkládá na čistý kov a oxid uhelnatý. K výrobě karbonylového železa z pentakarbonylu železa lze použít související postup .
Potravinářské technologie
Při ošetřování masa a ryb lze dosáhnout intenzivní barvy červeného masa ošetřením nízkými koncentracemi oxidu uhelnatého. Vazbou oxidu uhelnatého a myoglobinu vzniká komplex třešňově červené karboxymyoglobinu . To vizuálně simuluje již neexistující čerstvost . Basilejská kantonová laboratoř již prokázala použití dusitanu v tuňákovi jako náhradu . Oxid uhelnatý jako součást ochranného plynového obalu není v Evropské unii povolen.
Jiné použití
Adsorbovaný oxid uhelnatý se mnoha způsoby používá při charakterizaci heterogenních kontaktů a jiných povrchů. Kromě stanovení disperze center aktivních kovů pomocí chemisorpce se zkoumání adsorbovaného oxidu uhelnatého pomocí povrchově citlivých metod používá v průmyslovém a základním výzkumu v oblasti polovodičových technologií , palivových článků a výzkumu materiálů . V organokovové chemii poskytuje zkoumání ligandů oxidu uhelnatého pomocí infračervené spektroskopie širokou škálu informací, například o vazebných režimech oxidu uhelnatého, geometrii komplexu a náboji komplexu. V případě heteroleptických kovových karbonylů infračervená spektroskopie také poskytuje informace o vlastnostech a podmínkách vazby transgenu ligandu na oxid uhelnatý .
V kožešinových farmách se k udušení norka používá oxid uhelnatý a oxid , aby se srst co nejméně poškodila.
Svítiplynu , který byl produkován v průběhu koksování z černého uhlí , se skládal z přibližně 9 až 10% oxidu uhelnatého. Koksováním bylo získáno asi 350 m³ surového plynu na tunu uhlí . Po praní plynu, toto bylo uloženo v plynoměry a aromatizován s difosfan před tím, než byl propuštěn do plynárenské soustavy. Městský plyn byl původně používán pro pouliční osvětlení pomocí plynových luceren , odtud pochází název světelný plyn . Zhruba od roku 1910 sloužil k vaření a vytápění v soukromých domech. V 70. letech 20. století byl městský plyn z velké části nahrazen netoxickým zemním plynem .
Během nacistické éry byl oxid uhelnatý poprvé použit při hromadném zabíjení akce T4 v kontextu eutanazie a „zabíjení nehodného života“, při kterém byli vražděni hlavně duševně nemocní lidé. V některých nacistických vyhlazovacích táborech, například v koncentračním táboře Majdanek , byl oxid uhelnatý později použit k hromadnému zabíjení v plynových komorách nebo plynových dodávkách (buď jako součást výfukových plynů spalovacích motorů, nebo jako čistý CO z tlakových plynových lahví).
toxicita
Všeobecné

Oxid uhelnatý je nebezpečný dechový toxin, protože se snadno vstřebává plícemi. Protože je plyn bezbarvý, bez zápachu, bez chuti a nedráždivý , není téměř patrný. Úroveň individuální tolerance se liší. V průběhu let došlo k opakovaným velkolepým nehodám s oxidem uhelnatým, jako byla železniční nehoda Balvano (1944) nebo nehoda v Kelloggu (1972), z nichž některé si vyžádaly stovky obětí.
Když se dostane do krevního oběhu přes plíce, váže se na centrální atom železa hemoglobinu , čímž brání transportu kyslíku v krvi, což může vést ke smrti v důsledku udušení . Mezi příznaky mírné otravy patří bolest hlavy , závratě a příznaky podobné chřipce. Vyšší dávky jsou výrazně toxické pro centrální nervový systém a srdce. Oxid uhelnatý je příčinou více než poloviny všech smrtelných otrav na celém světě. Ve Spojených státech zemřelo v letech 1979 až 1988 na otravu oxidem uhelnatým přes 56 000 lidí, podle studie více než 25 000 případů sebevražedných otrav . Více než 15 000 případů souviselo s požárem a více než 11 000 případů bylo náhodnou smrtí bez požáru. Počet neúmyslných otrav výfukovými plyny z automobilů prudce klesá v důsledku rozšířeného používání třícestných katalyzátorů . Neotevřená otrava oxidem uhelnatým ve Spojených státech však v roce 2011 vyústila v přibližně 15 000 ošetření na pohotovosti v nemocnici a 500 úmrtí. V Německu existuje od 1. srpna 1990 povinnost hlásit otravu oxidem uhelnatým. Od tohoto data do 31. prosince 2008 obdržel Federální institut pro hodnocení rizik více než 57 000 lékařských zpráv o otravě nebo podezřelých případech, tj. Přibližně 3 000 ročně.
účinek
Procento hemoglobinu pokrytého oxidem uhelnatým v krvi se také zkracuje jako COHb (hemoglobin oxidu uhelnatého) . Podle starších studií neexistuje žádné nebezpečí pro zdravé dospělé ani při nepřetržité expozici osm hodin denně při koncentracích až 115 ppm ; u nekuřáků jsou pouze koncentrace 4% COHb a u kuřáků 7,6% . Nedávné studie však ukazují, že v rizikových skupinách s kardiovaskulárními chorobami mohou úrovně stresu 2,7% a více zvýšit příznaky onemocnění. Při vyšší chronické expozici nad 150 až 300 ppm dochází k závratím, ospalosti, nevolnosti a zvracení. Akutně smrtící množství plynu ( LC 50 ) viz informační pole (výše). Hluchota se při vystavení CO zvyšuje až o 50%. Jiné zdroje, které odkazují na novější studie, však předpokládají, že hodnoty 2–5% COHb již vedou k prvním symptomům. Například 2% COHb narušuje vnímání času , sotva znatelně . Při hodnotách COHb pod 20% únavy dochází k bolestem hlavy , bušení srdce a poruchám zraku . Příznaky jako ospalost , závratě a svalová slabost jsou známy v rozmezí 20 až 30% . V rozmezí 30 až 50% COHb dochází k nevolnosti , zvracení , poruchám koncentrace , zvonění v uších , ztrátě vědomí a oběhovému kolapsu . Kůže zrůžoví. Od hodnoty COHb 50%nastává hluboké bezvědomí doprovázené křečemi a poruchami dýchání. Pak nastává akutní ohrožení života. Smrt nastává s hladinami COHb 60 až 70%. Asi 85% vdechovaného oxidu uhelnatého je vázáno v krvi, zbývajících 15% je vázáno v myoglobinu jako třešňově červený karboxymyoglobin .
Individuální tolerance oxidu uhelnatého je ovlivněna různými faktory, jako je vykonávaná aktivita, rychlost dýchání , předchozí poškození nebo nemoci ( krevní oběh , anémie nebo srpkovitá anémie ). Dalšími faktory jsou atmosférický tlak nebo bazální rychlost metabolismu .
Oxid uhelnatý se váže asi 250 až 325krát více na červený krevní pigment hemoglobin než kyslík , při koncentraci 0,1% Kohlenstoffmonoxidanteil v dýchajícím vzduchu, takže asi polovina červených krvinek je deaktivována. Jedovatý účinek oxidu uhelnatého je snížen proteinovým prostředím hemu v hemoglobinu, takže se oxid uhelnatý váže na nerušený hem asi 26 000krát silněji než kyslík. Předpokládá se, že příčinou je nedostatek prostoru v kapse enzymu, který by umožňoval lineární geometrii Fe -CO upřednostňovanou oxidem uhelnatým, ale úhlová koordinace preferovaná dioxygenem není bráněna. Při obsahu vzduchu kolem 0,5% objemu dojde k úmrtí během několika minut. Eliminační poločas oxidu uhelnatého z krve je 2 až 6,5 hodiny, v závislosti na množství absorbovaného oxidu uhelnatého a rychlosti ventilace osoby.
Následné poškození
Kromě akutní otravy dochází k následným škodám. Oxid uhelnatý má vážné negativní účinky na vývoj plodu. Chronické vystavení nízkým hladinám oxidu uhelnatého může vést k depresi . Expozice vyšší než 100 ppm jsou v průměru považovány za zdraví škodlivé. Expozici na mez (OEL - dříve: hodnota MAK) je 30 ppm. Oxid uhelnatý může snížit délku života poškozením srdce. Profesionální otrava oxidem uhelnatým je uznávána jako nemoc z povolání . V letech 2005 až 2008 bylo podle zpráv federálního ministerstva práce a sociálních věcí každoročně hlášeno přibližně 126 nemocí způsobených oxidem uhelnatým.
Diagnóza
Vazbou oxidu uhelnatého na hemoglobin jsou konvenční pulzní oxymetry oklamány a nesprávně indikují vysokou míru nasycení kyslíkem. U novějších pulsních oxymetrů se 7 vlnovými délkami lze však detekovat také frakci hemoglobinu nasycenou CO. Vnějšími známkami otravy oxidem uhelnatým jsou třešňově červené sliznice . Podle novějších studií s vysokým počtem případů (231 pacientů) se s tímto klinickým příznakem setkáváme jen zřídka, zejména u lehčích forem intoxikace. Barva je výsledkem komplexů přenosu červeného hemoglobinu s oxidem uhelnatým . Kromě toho mohou být mrtvá místa (živorodci), která se objevují na mrtvolu po smrti, také tímto mechanismem zbarvena jasně červeně, a tak dávat náznak otravy oxidem uhelnatým.
terapie
Pacienti s těžkou otravou oxidem uhelnatým jsou obvykle intubováni a ventilováni pomocí pozitivního tlaku na konci přílivu a odlivu ( PEEP ) a 100% kyslíku . Kvůli výrazně zvýšenému přísunu kyslíku je oxid uhelnatý vytlačen hemoglobinem. Lze uvažovat o hyperbarické oxygenaci .
Poločas , s níž zvýšená koncentrace CO v krvi (CO- Hb hodnota) padá vydechování na čerstvém vzduchu, je asi 3-8 hodin. Poločas lze snížit nucenou kyslíkovou terapií (hyperventilace čistým kyslíkem pomocí orotracheální intubace) až na 45 minut.
Biologický význam
osoba
U lidí je podíl hemoglobinu COHb v krvi, který je potažen oxidem uhelnatým, mezi 0,7 a 1,1% v žilní krvi, z čehož asi 0,5% je produkováno endogenně . Zvýšená hladina oxidu uhelnatého v buňkách vede k až 1000krát zvýšenému uvolňování glykoproteinu erytropoetinu (EPO) .
Poselská látka
Enzym hem oxygenasa staví heme sloučeniny skládající se převážně z hemoglobinu odvozené, s uvolňováním oxidu uhelnatého z. Tento enzym a guanylátcyklázu , která je regulována oxidem uhelnatým, bylo možné detekovat v čichovém centru lidského mozku a v čichovém bulbu . Podle toho by mohl oxid uhelnatý sloužit jako plynná poselská látka (viz plynový vysílač ) pro čich. Aktivovaná guanylátcykláza uvolňuje sekundární poselskou látku cGMP . Za druhý posel je kromě oxidu uhelnatého, cGMP a cAMP považován také oxid dusnatý . Oxid dusičitý i oxid uhelnatý, jakožto extrémně nízkomolekulární, ve vodě rozpustné plyny, mohou velmi rychle a relativně nerušeně pronikat biomembránami, a proto slouží jako neurotransmitery při přenosu informací z primární nebo senzorické do sekundární nebo dlouhodobé paměti prostřednictvím limbický systém .
Protizánětlivé vlastnosti
Oxid uhelnatý má protizánětlivý účinek při chronických střevních zánětech, což vysvětluje dříve záhadný fakt, že kuřáci mají mnohem menší pravděpodobnost vzniku ulcerózní kolitidy než nekuřáci. I po transplantaci plic vdechnutím nízkých dávek oxidu uhelnatého předchází poškození ischemií nebo reperfuzí . Pokud jsou ledviny určené k transplantaci uchovávány v roztoku s nízkými koncentracemi oxidu uhelnatého, je jinak pozorované zvýšení volného hemu a snížení cytochromu P450 inhibováno, a tím je snížena peroxidace lipidů poškozující buňky . Příznivé účinky oxidu uhelnatého byly také popsány na zvířecích modelech septického šoku , střevní obstrukce (ileus) a arteriosklerózy . U žen s gestační hypertenzí a těhotenskou otravou (preeklampsie) je koncentrace oxidu uhelnatého ve vydechovaném vzduchu snížena. Ženy, které kouří, mají snížené riziko vzniku preeklampsie. Vyvíjejí se léky, které mohou transportovat a uvolňovat kontrolovaná množství oxidu uhelnatého.
Anaerobní dýchání v archea
Při tvorbě metanu ( methanogeneze ) používá oxid uhelnatý několik archea jako substrát pro anaerobní dýchání . Methanothermobacter thermoautotrophicus a Methanosarcina barkeri tvoří tři molekuly CO 2 a jednu molekulu metanu ze čtyř molekul CO , podle:
Také Methanosarcina acetivorans může používat CO jako substrát, kde se tvoří paralelní acetát a mravenčan . Tento typ acetogeneze v methanogenech se nazývá karboxidotrofní acetogeneze .
Energie a zdroj uhlíku oxidu uhelnatého využívající bakterie
| Fyziologická skupina (ne všechny mohou růst s CO, zelená: aerobní, červená: anaerobní) | zkoumaný zástupce | Reakční rovnice |
|---|---|---|
| Karboxidotrofní bakterie | Oligotropha carboxidovorans | 2 CO + O 2 → 2 CO 2 |
| Hydrogenogenní bakterie | Carboxydothermus hydrogenoformans | CO + H 2 O → CO 2 + H 2 |
| Acetogenní bakterie |
Moorella thermoacetica (dříve známá jako Clostridium thermoaceticum ) |
4 CO + 2 H 2 O → CH 3 COOH + 2 CO 2 |
| Fototrofní bakterie |
Rhodospirillum rubrum (srovnej Winogradsky sloupec ) |
CO + H 2 O → CO 2 + H 2 |
| Sulfidogenní bakterie | Desulfovibrio vulgaris | 4 CO + H 2 SO 4 → 4 CO 2 + H 2 S |
Jen málo bakterií je schopno použít jako substrát oxid uhelnatý. Používají to k vytváření organických sloučenin ( asimilace oxidu uhličitého ) a k výrobě energie. K aerobně žijící carboxidobacteria jsou mezi bakteriemi, které využívají oxid uhelnatý . Jsou fakultativně chemolitoautotrofní , což znamená, že žijí z oxidace anorganických látek. Carboxidobacteria oxidují oxid uhelnatý v přítomnosti kyslíku na oxid uhličitý, podle:
Alternativně mohou některé druhy místo kyslíku použít také dusičnan (NO 3 - ) ( denitrifikace ), to se provádí s vyloučením kyslíku ( anaerobní ). Dobře studovaným aerobním oxidačním činidlem CO je Oligotropha carboxidovorans . Carboxidobacteria tak pravděpodobně působí proti znečištění ovzduší atmosférou CO.
Existuje také řada přísně anaerobních chemolitotrofů, které oxidují CO v nepřítomnosti kyslíku. Tak se to děje u Carboxydothermus hydrogenoformans podle:
Klíčovým enzymem u obou typů je oxid uhelnatý dehydrogenáza (CODH). Aerobní CODH obsahuje měď a molybden , zatímco CODH přísně anaerobních bakterií používá železo a nikl .
důkaz
Je známo několik typů senzorů oxidu uhelnatého. Jsou založeny na detekci opto-chemické, infračervené nebo tepelné měření vodivosti , měření působení tepla , elektrochemických procesů, nebo na polovodičové bázi . Nejjednodušší konstrukce má optochemické senzory, které indikují změnu barvy chemické látky při jejím kontaktu s oxidem uhelnatým. Senzory jsou jednoduché a levné, ale zobrazení oxidu uhelnatého je kvalitativnější. Tvorba kovových karbonylů slouží jako optochemický displej. Přesnější měření koncentrace oxidu uhelnatého je možné pomocí elektrochemických senzorů nebo senzorů na bázi polovodičů. Nedisperzní infračervené senzory jsou rozšířené . Dnes jsou na trhu přenosné a stacionární elektronické senzory ( varovná zařízení pro plyn ), které umožňují detekci oxidu uhelnatého v rozsahu 20 až 2000 ppm ve vzduchu v místnosti. Alarm se obvykle vyskytuje na základě funkce koncentrace-času, aby se pokud možno zabránilo falešným poplachům, například z cigaretového kouře.
Diiodopentoxid I 2 O 5 se také používá jako přesné detekční činidlo , které je kvantitativně redukováno na elementární jód I 2 v U-trubici při vyšších teplotách (přibližně 80–160 ° C) za přítomnosti oxidu uhelnatého , se současnou tvorbou z oxidu uhličitého CO 2 :
Změna barvy je také vhodná pro detekci pomocí zkumavek . Obsah CO v plynu může být stanovena pomocí zpětného titrací na jód se thiosíranu S 2 O 3 2- ( jodometricky ). Alfred Ditte zkoumal tento proces s oxidem dijodidem již v roce 1870. Vodík - i ve vyšších koncentracích - má jen velmi minimální vliv na přesnost detekce této metody. Simultánní kvantitativní stanovení převedeného oxidu uhličitého (stanovení pomocí vodivosti nebo srážením roztoku hydroxidu barnatého ) činí měření velmi přesným.
Oxid uhelnatý reaguje s vodnými roztoky soli paladia i při pokojové teplotě . Při tomto postupu se soli Pd 2+ redukují na kovové palladium, přičemž oxid uhelnatý se oxiduje na oxid uhličitý. Srážení jemně rozptýleného kovového palladia zbarví roztok vzorku na tmavý a indikuje tak oxid uhelnatý.
literatura
- AF Holleman , E. Wiberg , N. Wiberg : Učebnice anorganické chemie . 102. vydání. Walter de Gruyter, Berlín 2007, ISBN 978-3-11-017770-1 , s. 896-900.
- Pokyny S1 fungují pod vlivem oxidu uhelnatého (oxidu uhelnatého) Německé společnosti pro pracovní lékařství a lékařství životního prostředí. In: AWMF online (od roku 2011)
- Louis Lewin : Historie otravy oxidem uhličitým. In: Sudhoffs Archiv 3, 1910, s. 1–35.
webové odkazy
Individuální důkazy
- ↑ b c d e f g h i j k l m n o p q r vstupu na oxid uhelnatý v databázi GESTIS látkové v IFA , přístupné 8. ledna 2021. (Vyžadován JavaScript)
- ↑ a b David R. Lide (Ed.): CRC Handbook of Chemistry and Physics . 90. vydání. (Internetová verze: 2010), CRC Press / Taylor and Francis, Boca Raton, FL, Dipole Moments, s. 9-53.
- ↑ Vstup na oxid uhelnatý v seznamu klasifikací a označení všech v Evropské agentury pro chemické látky (ECHA), k dispozici na 1. února 2016. Výrobci a distributoři mohou rozšířit do harmonizované klasifikace a označování .
- ↑ Švýcarský fond úrazového pojištění (Suva): Mezní hodnoty-aktuální hodnoty MAK a BAT (hledejte 630-08-0 nebo oxid uhelnatý ), přístup 2. listopadu 2015.
- ↑ Termodynamická data CO. Národní institut pro standardy a technologie, březen 2013, archiv z originálu 2. února 2015 ; přístup 16. srpna 2014 .
- ^ IUPAC: Nomenklatura anorganické chemie. Německé vydání doporučení 1990. VCH, Weinheim 1994, ISBN 3-527-25713-6 , s. 76.
- ↑ Ivan Blumenthal: Otrava oxidem uhelnatým. In: Journal of the Royal Society of Medicine. Svazek 94, č. 6, červen 2001, s. 270-272, PMC 1281520 (volný plný text).
- ↑ John Hrastar: kapalný zemní plyn ve Spojených státech: Historie. Mcfarland & Co Inc., 2014, ISBN 978-0-7864-7859-0 , s. 32.
- ^ RE Schofield: Osvícený Joseph Priestley. Studie o jeho životě a díle v letech 1773 až 1804. Pennsylvania State University Press, 2004, ISBN 978-0-271-03625-0 , s. 103.
- ^ Guy H. Neild: William Cruickshank (FRS - 1802): klinický chemik. (PDF; 1,7 MB) Citováno 26. července 2014 .
- ^ Henry Friedlander: Počátky nacistické genocidy: Od eutanazie po konečné řešení . The University of North Carolina Press, 1997, ISBN 978-0-8078-4675-9 , pp. 123 .
- ↑ a b c M. AK Khalil, RA Rasmussen: The Global Cycle of Carbon Monoxide: Trends and Mass Balance . In: Chemosphere . páska 20 , 1990, s. 227-242 (anglicky).
- ↑ a b c d M. AK Khalil, JP Pinto, MJ Shearer: Atmosférický oxid uhelnatý . In: Chemosphere: Global Change Science . páska 1 , s. xi - xiii (anglicky).
- ↑ a b Terra je pět: Jak Terra sleduje znečištění. In: earthobservatory.nasa.gov. 11. března 2011, přístup 8. ledna 2015 .
- ↑ a b c d e Integrované vědecké hodnocení oxidu uhelnatého. EPO, 2010, přístup 29. srpna 2014 .
- ↑ Sachin D. Ghude, G. Beig: Satelit pozoroval regionální distribuci troposférického oxidu dusičitého (NO2) a oxidu uhelnatého (CO) na indickém subkontinentu. (PDF) Citováno 21. září 2014 (anglicky).
- ^ O. Badr, SD Probert: Dřezy a dopady na životní prostředí pro atmosférický oxid uhelnatý. In: Aplikovaná energie. Svazek 50, 1995, s. 339-372.
- ↑ W. Seiler, C. Junge: Oxid uhelnatý v atmosféře. In: Journal of Geophysical Research. Svazek 75, 1970, s. 2217-2226, doi: 10,1029 / JC075i012p02217 .
- ↑ JW Swinnerton, VJ Linnenbom, RA Lamontagne: The Ocean: A Natural Source of Carbon Monoxide. In: Věda. Svazek 167, 1970, s. 984-986, doi: 10,1126 / věda.167,3920,984 .
- ↑ Detlev Möller: Vzduch: chemie, fyzika, biologie, čistota, právo. Verlag de Gruyter, 2003, ISBN 3-11-016431-0 , s. 18.
- ↑ JC McConnell, MB McElroy, SC Wofsy: Přírodní zdroje atmosférického CO. In: Příroda. Svazek 233, 1971, s. 187-188, doi: 10,1038 / 233187a0 .
- ↑ Integrované vědecké hodnocení oxidu uhelnatého. Americká agentura pro ochranu životního prostředí, leden 2010, přístup 16. srpna 2014 .
- ^ Robert C. MacDonald, Ray Fall: Detekce značných emisí methanolu z rostlin do atmosféry. In: Atmosférické prostředí. Část A. Obecná témata. Svazek 27, č. 11, 1993, s. 1709-1713, doi: 10,1016 / 0960-1686 (93) 90233-O .
- ^ Siegfried Fred Singer: Měnící se globální prostředí . D. Reidel Publishing Company , Dordrecht 1975, ISBN 90-277-0385-X , s. 90 ( omezený náhled ve vyhledávání knih Google).
- ↑ a b Tom Gosink: Co znamenají úrovně oxidu uhelnatého? In: Aljašské vědecké fórum. Geofyzikální institut, University of Aljaška Fairbanks, 28. ledna 1983, archiv z originálu 25. prosince 2008 ; Citováno 1. prosince 2007 .
- ↑ Dusan Gruden: Ochrana životního prostředí v automobilovém průmyslu: motor, paliva, recyklace vázaná kniha. Vieweg + Teubner Verlag, 2008, ISBN 978-3-8348-0404-4 , s. 127.
- ↑ Snížení emisí znečišťujících látek z lehkých vozidel. In: Nařízení Evropského parlamentu a Rady (ES) č. 715/2007 ze dne 20. června 2007 o schvalování typu motorových vozidel z hlediska emisí z lehkých osobních a užitkových vozidel (Euro 5 a Euro 6) a o přístup k informacím o opravách a údržbě vozidel. Evropská unie, 29. března 2013, přístup 11. srpna 2014 .
- ↑ Katja Petzold: Klimatologie oxidů dusíku, ozonu a oxidu uhelnatého v troposféře: analýza datového souboru MOZAIC. Zprávy z Forschungszentrum Jülich, 4327, ISSN 0944-2952 , s. 6.
- ↑ Horst Fischer, Heiko Bozem, Jos Lelieveld: Fotochemická produkce ozónu v troposféře. Max Planck Institute for Chemistry, 2011, přístup 29. srpna 2014 .
- ↑ B. Weinstock, H. Niki: Rovnováha oxidu uhelnatého v přírodě. In: Věda. Svazek 176, 1972, s. 290-292, doi: 10,1126 / věda.176.4032.290 .
- ↑ Metody a standardy pro měření životního prostředí: Proceedings of the 8th Materials Research Symposium Held at the National Bureau of Standards. Gaithersburg, Maryland, 20. – 24. Září 1976, číslo 464, s. 440.
- ↑ Claus Bliefert: Chemie životního prostředí . 3. Edice. Wiley-VCH, Weinheim 2002, ISBN 3-527-30374-X , s. 9 ( omezený náhled ve vyhledávání knih Google).
- ↑ Nebezpečí z komína. In: Berliner Kurier. 15. listopadu 2006, přístup 17. srpna 2014 .
- ↑ a b Zelená W: Úvod do kvality vnitřního ovzduší: Oxid uhelnatý (CO). United States Environmental Protection Agency, přístup 16. prosince 2008 .
- ^ A. Hahn, K. Begemann, R. Burger, M. Friedemann, J. Hillebrand, H. Meyer, R. Kolbusa, M. Gessner: Ärztliche Mitteilungen bei Vergiftungen 2008 . Ed.: Tiskové oddělení Spolkového institutu pro hodnocení rizik. Berlin 2010, ISBN 3-938163-54-2 , s. 58 .
- ↑ Vyhněte se jedovatým plynům z bunkru na pelety. Federální institut pro hodnocení rizik, 17. července 2014, přístup 12. srpna 2014 .
- ↑ Sabine Sickinger, Stefan Sellmeier, Oliver Meisenberg, Sebastian Schöttner: Otrava oxidem uhelnatým ventilačními zařízeními? In: požární ochrana . Ne. 7 , 2011, s. 538-540 .
- ^ Zásady řízení kouření v Queenslandu pro zdraví. (Online již není k dispozici.) QH, archivováno z originálu 15. listopadu 2014 ; Citováno 1. března 2010 .
- ↑ Toni Fischer a kol.: Znečištění ovzduší tabákovým kouřem v restauracích . In: ETH Zurich (Ed.): International Archives of Occupational and Environmental Health . páska 41 , 1978, s. 267–280 ( ucsf.edu - ethz.ch (PDF) abstrakt [přístup 26. srpna 2015]).
- ↑ D. Talbi, E. Herbst: Zničení plynné fázi mezihvězdného oxidu uhličitého: Výpočty reakce mezi CO 2 a H 2 a mezi CO 2 a H . In: Astronomie a astrofyzika . páska 386 , č. 3 , 2002, s. 1139-1142 , doi : 10,1051 / 0004-6361: 20020312 .
- ↑ a b M. Oppenheimer, A. Dalgarno: Tvorba oxidu uhelnatého a tepelná rovnováha v mezihvězdných oblacích. In: The Astrophysical Journal. Svazek 200, 1975, s. 419-425 , bibcode : 1975ApJ ... 200..419O . doi: 10,1086 / 153805 .
- ^ TR Ayers: Tepelné rozdvojení vnější fotosféry. In: Solar Photosphere: Structure, Convection, and Magnetic Fields. In: Sborník ze 138. sympozia Mezinárodní astronomické unie. Springer, 1989, ISBN 0-7923-0529-9 , s. 23-28.
- ^ Gordon Newkirk Jr.: Oxid uhelnatý ve sluneční atmosféře. In: The Astrophysical Journal. Svazek 125, 1957, s. 571, bibcode : 2005A & A ... 438,1043W . doi: 10,1051 / 0004-6361: 20042550 .
- ↑ Pierre Connes a kol.: Oxid uhelnatý v atmosféře Venuše. In: The Astrophysical Journal. Svazek 152, 1968, s. 731-743, bibcode : 1968ApJ ... 152..731C . doi: 10,1086 / 149590 .
- ^ Lewis D. Kaplan, Janine Connes, Pierre Connes: Oxid uhelnatý v atmosféře Marsu. In: The Astrophysical Journal. Svazek 157, 1969, s. L187, bibcode : 1969ApJ ... 157L.187K ; doi: 10,1086 / 180416 .
- ^ R. Beer: Detekce oxidu uhelnatého v Jupiteru. In: The Astrophysical Journal. Svazek 200, 1975, s. L167- L169 , bibcode : 1975ApJ ... 200L.167B . doi: 10,1086 / 181923 .
- ↑ Keith S.Noll a kol.: Detekce oxidu uhelnatého v Saturnu. In: The Astrophysical Journal. Svazek 309, 1986, s. L91-L94, bibcode : 1986ApJ ... 309L..91N . doi: 10,1086 / 184768 .
- ↑ MA Lopez-Valverde, E. Lellouch, A. Coustenis: Fluorescence oxidu uhelnatého z atmosféry Titanu. In: Icarus. Svazek 175, 2005, s. 503-521, doi: 10,1016 / j.icarus.2004.12.015 .
- ↑ A. Marten et al.: První pozorování CO a HCN na Neptunu a Uranu na milimetrových vlnových délkách a důsledky pro atmosférickou chemii. In: The Astrophysical Journal. Svazek 406, 1993, s. 285-297, bibcode : 1993ApJ ... 406..285M . doi: 10,1086 / 172440 .
- ↑ K. Lodders: Původ oxidu uhelnatého v atmosféře Neptunu. In: Icarus. Svazek 112, 1994, s. 368-375, doi: 10,1006 / icar.1994.1190 .
- ↑ Detlev Möller: Vzduch: chemie, fyzika, biologie, čistota, právo. Verlag de Gruyter, 2003, ISBN 3-11-016431-0 , s. 17.
- ↑ Ken Croswell: Dusík v atmosféře Pluta. In: KenCroswell.com. 20. června 1992. Získáno 28. června 2013 .
- ↑ QM Konopacky, TS Barman, BA Macintosh, C. Marois: Detection Carbon Monoxide and Water Absorption Lines in an Exoplanet Atmosphere. In: Věda. Svazek 339, 2013, s. 1398-1401, doi: 10,1126 / věda.1232003 .
- ↑ Halley: Průlet 13. března 1986. In: ESA.int. ESA, přístup 28. června 2013 .
- ↑ Michael A. DiSanti: Důkaz pro dominantní nativní zdroj oxidu uhelnatého v kometě C / 1996 B2 (Hyakutake). In: Journal of Geophysical Research. Svazek 108, 2003, s. 5061, doi: 10,1029 / 2002JE001961 .
- ↑ Michael A. DiSanti, Michael J. Mumma, Neil Dello Russo, Karen Magee-Sauer, Robert Novak, Terrence W. Rettig: Identifikace dvou zdrojů oxidu uhelnatého v kometě Hale-Bopp. In: Příroda. Svazek 399, 1999, s. 662-665, doi: 10,1038 / 21378 .
- ^ Matthew C. Senay, David Jewitt: Tvorba kómatu poháněná uvolňováním oxidu uhelnatého z komety Schwassmann-Wachmann 1. In: Nature. Svazek 371, s. 229-230, doi: 10,1038 / 371229a0 .
- ↑ Damon P. Simonelli, James B. Pollack, Christopher P. Mckay, Ray T. Reynolds, Audrey L. Summers: Rozpočet uhlíku ve vnější sluneční mlhovině. In: Icarus. Svazek 82, 1989, s. 1-35, doi: 10,1016 / 0019-1035 (89) 90020-1 .
- ↑ Muriel Gargaud, Ricardo Amils: Encyklopedie astrobiologie. Svazek 1, Springer, 2011, ISBN 978-3-642-11271-3 , s. 245–246 ( omezený náhled ve vyhledávání knih Google).
- ↑ Craig Kulesa: Přehled: Molekulární astrofyzika a vznik hvězd. 17. října 1999, přístup 27. července 2014 .
- ↑ Gerrit L. Verschuur: Mezihvězdné záležitosti: Eseje o zvědavosti a astronomickém objevu. Springer, 2013, ISBN 978-3-7643-6696-4 , s. 247.
- ^ WB Burton, MA Gordon: Oxid uhelnatý v Galaxii. III. Celková povaha jeho distribuce v rovníkové rovině. In: Astronomie a astrofyzika. Svazek 63, 1978, s. 7-27, bibcode : 1978A & A .... 63 .... 7B .
- ^ Klaus Weissermel , Hans-Jürgen Arpe : Průmyslová organická chemie . 3. Edice. VCH, Weinheim 1997, ISBN 3-527-28838-4 , s. 15 .
- ^ Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner: Průmyslová anorganická chemie . 2. vydání. Wiley-VCH, Weinheim 2000, ISBN 978-3-527-29849-5 , s. 15 .
- ↑ a b Jürgen Bierhals: Oxid uhelnatý . In: Ullmannova encyklopedie průmyslové chemie . 6. vydání. Wiley-VCH, Weinheim 2002, ISBN 978-3-527-30385-4 .
- ^ A b Karl-Heinz Schmidt, Ingo Romey, Fritz Mensch: Uhlí, ropa, zemní plyn: chemie a technologie. Vogel Verlag, 1981, ISBN 3-8023-0684-8 , s. 56-64.
- ^ A b c d Karl-Heinz Schmidt, Ingo Romey, Fritz Mensch: Uhlí, ropa, zemní plyn: chemie a technologie. Vogel Verlag, 1981, ISBN 3-8023-0684-8 , s. 65.
- ↑ a b c d e A. F. Holleman , E. Wiberg , N. Wiberg : Učebnice anorganické chemie . 102. vydání. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , s. 898.
- ↑ R. Conrad: Nové chemické procesy. In: Technologie chemického inženýra - CIT. Svazek 42, 1970, s. 1555-1568, doi: 10,1002 / cit . 330422410 .
- ^ Gaurav Nahar, Valerie Dupont: Výroba vodíku z jednoduchých alkanů a okysličených uhlovodíků nad katalyzátory na bázi ceria-zirkonia: Recenze. In: Recenze obnovitelné a udržitelné energie . Svazek 32, 2014, s. 777-796, doi: 10,1016 / j.rser.2013.12.040 .
- ↑ Ekkehard Fluck, Carl Mahr: Anorganická základní stáž . 6. vydání. VCH, Weinheim 1985, ISBN 3-527-26032-3 , s. 234 .
- ↑ Georg Brauer (Ed.), Se spoluprací Marianne Baudler a dalších: Příručka preparativní anorganické chemie. 3., přepracované vydání. Svazek II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3 , s. 621-622.
- ^ A b c d Karl-Heinz Schmidt, Ingo Romey, Fritz Mensch: Uhlí, ropa, zemní plyn: chemie a technologie. Vogel Verlag, 1981, ISBN 3-8023-0684-8 , s. 175-176.
- ^ Allen I. Katz, David Schiferl, Robert L. Mills: Nové fáze a chemické reakce v pevném oxidu uhelnatém pod tlakem. In: The Journal of Physical Chemistry. Svazek 88, 1984, s. 3176-3179, doi: 10,1021 / j150659a007 .
- ↑ M. Lipp, WJ Evans, V. Garcia-Baonza, HE Lorenzana: Carbon Monoxide: Spectroscopic Characterization of the High-Press Polymerized Phase. In: Journal of Low Temperature Physics. Svazek 111, 1998, s. 247-256, doi: 10,1023 / A: 1022267115640 .
- ↑ N. Rademacher, L. Bayarjargal, W. Morgenroth, B. Winkler, J. Ciezak-Jenkins: Příprava a charakterizace pevného oxidu uhelnatého při vysokém tlaku v buňce diamantové kovadliny. (PDF) DESY, 2011, přístup 9. srpna 2014 .
- ↑ http://www.uni-magdeburg.de/isut/TV/Download/Kapitel3_VerbrnungSS2003.pdf
- ↑ Linus Pauling: Základy chemie. Verlag Chemie, 1969, ISBN 3-527-25392-0 , s. 149.
- ^ JE Huheey, EA Keiter, RL Keiter: Anorganická chemie: Principy struktury a reaktivity. de Gruyter, 2003, ISBN 3-11-017903-2 , s. 173.
- ^ AF Holleman , E. Wiberg , N.Wiberg : Učebnice anorganické chemie . 102. vydání. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , s. 1789.
- ↑ B. Rosenblum, A. Nethercot, C. Townes: Izotopické hmotnostní poměry, magnetické momenty a znak momentu elektrického dipolu v oxidu uhelnatém. In: Fyzický přehled. Svazek 109, 1958, s. 400-412, doi: 10,1103 / PhysRev.109.400 .
- ^ AF Holleman , E. Wiberg , N.Wiberg : Učebnice anorganické chemie . 102. vydání. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , s. 900.
- ↑ L. Gattermann, JA Koch: Syntéza aromatických aldehydů. In: Zprávy Německé chemické společnosti. Svazek 30, 1897, s. 1622-1624, doi: 10,1002 / cber.18970300288 .
- ↑ WA Herrmann : 100 let kovových karbonylů. Náhodný objev dělá historii. In: Chemie v naší době . Svazek 22, č. 4, 1988, s. 113-122, doi: 10,1002 / ciuz.19880220402 .
- ^ A b Wilhelm Keim, Arno Behr, Günther Schmitt: Základy průmyslové chemie. Otto Salle Verlag, 1985, ISBN 3-7935-5490-2 , s. 104.
- ↑ Zprovoznění plynovodu oxidu uhelnatého Bayer Dormagen-Krefeld / Uerdingen se prozatím zastavilo. (Již není k dispozici online.) Vyšší správní soud Severní Porýní-Vestfálsko, 18. prosince 2007, archiv z originálu 14. července 2014 ; Citováno 13. července 2014 .
- ^ Wilhelm Keim, Arno Behr, Günther Schmitt: Základy průmyslové chemie. Otto Salle Verlag, 1985, ISBN 3-7935-5490-2 , s. 179-182.
- ↑ Andrei Y. Khodakov, Wei Chu, Pascal Fongarland: Pokroky ve vývoji nových kobaltových katalyzátorů pro Fischer-Tropschovu syntézu uhlovodíků s dlouhým řetězcem a čistých paliv. In: ChemInform. Svazek 38, 2007, s. 1692-1744, doi: 10,1002 / brada.200733255 .
- ↑ PL Spath, DC Dayton: Předběžný screening - technické a ekonomické hodnocení syntézního plynu do paliv a chemikálií s důrazem na potenciál pro syntézu odvozenou z biomasy. (PDF) In: NREL / TP510-34929. National Renewable Energy Laboratory, prosinec 2003, přístup 16. srpna 2014 .
- ^ A b Wilhelm Keim, Arno Behr, Günther Schmitt: Základy průmyslové chemie. Otto Salle Verlag, 1985, ISBN 3-7935-5490-2 , s. 185-187.
- ^ A b Wilhelm Keim, Arno Behr, Günther Schmitt: Základy průmyslové chemie. Otto Salle Verlag, 1985, ISBN 3-7935-5490-2 , s. 239-240.
- ↑ a b Tradice nápadů: kyselina mravenčí. Prosinec 2012, přístup 11. července 2014 .
- ^ Wilhelm Keim, Arno Behr, Günther Schmitt: Základy průmyslové chemie. Otto Salle Verlag, 1985, ISBN 3-7935-5490-2 , s. 241-243 .
- ^ Joseph R. Zoeller, Victor H. Agreda, Steven L. Cook, Norma L. Lafferty, Stanley W. Polichnowski, David M. Pond: Proces acetanhydridu chemické společnosti Eastman. In: Catalysis Today . Svazek 13, 1992, str. 73-91, doi: 10,1016 / 0920-5861 (92) 80188-S .
- ↑ A. Gossauer: Struktura a reaktivita biomolekul. Helvetica Chimica Acta, Curych 2006, ISBN 3-906390-29-2 , s. 155.
- ↑ Jürgen Falbe, Helmut Bahrmann: Homogenní katalýza v technologii. In: Chemie v naší době. Svazek 15, 1981, s. 37-45, doi: 10,1002 / ciuz.19810150203 .
- ↑ L. Mond, C. Langer, F. Quincke: Akce oxidu uhelnatého na nikl. In: J. Chem. Soc. 1890, 57, s. 749-753 ( doi: 10,1039 / CT8905700749 ).
- ↑ Ludwig Mond, Heinrich Hirtz, Matthewman Dalton Cowap: Poznámka k těkavé směsi kobaltu s oxidem uhelnatým. In: Chem. Zprávy. Sv. 98, 1908, s. 165; Chem. Abs. Sv. 2, 1908, s. 3315.
- ↑ Dirk Steinborn: Základy katalýzy organokovových komplexů. Teubner, Wiesbaden 2007, ISBN 978-3-8351-0088-6 , s. 83.
- ^ Wilhelm Keim, Arno Behr, Günther Schmitt: Základy průmyslové chemie. Otto Salle Verlag, 1985, ISBN 3-7935-5490-2 , s. 391.
- ^ Günther Neroth, Dieter Vollenschaar: Železo a ocel. In: Wendehorst building materials science. Vieweg + Teubner Verlag, 2011, ISBN 978-3-8351-0225-5 , s. 637-702.
- ↑ David R. Lide (Ed.): CRC Handbook of Chemistry and Physics . 90. vydání. (Internetová verze: 2010), CRC Press / Taylor and Francis, Boca Raton, FL, Heat of Combustion, s. 5-70.
- ↑ L. Mond, C. Langer, F. Quincke: Akce oxidu uhelnatého na nikl. In: J. Chem. Soc. Svazek 57, 1890, s. 749-753, doi: 10,1039 / CT8905700749 .
- ↑ Eckard Amelingmeier a kol.: RÖMPP Lexikon Chemie. Svazek 4, 10. vydání, 1996–1999, Georg Thieme Verlag, ISBN 978-3-13-200031-5 , s. 2008.
- ↑ Dolní Sasko, státní úřad pro ochranu spotřebitele a bezpečnost potravin : Ryba vidí červeně - ošetření, skladování a přeprava čerstvých ryb
- ↑ Ministerstvo zdravotnictví kantonu Basilej-Stadt: Nelegální barvení masa z tuňáka. In: gd.bs.ch . 28. května 2019. Získáno 28. května 2019 .
- ↑ Ludwig Bergmann, Clemens Schaefer: Učebnice experimentální fyziky, svazek 6. Solid. Gruyter, 2005, ISBN 3-11-017485-5 , s. 335-336.
- ↑ K. Veera Reddy: Symetrie a spektroskopie molekul. New Age Science Ltd., 2005, ISBN 81-224-1142-8 , s. 381.
- ^ Vyhláška o chovu kožešinových zvířat . § 6 Zabíjení . (Již není k dispozici online.) 29. září 1998, archivováno z originálu 8. července 2012 ; Citováno 29. srpna 2014 .
- ^ Karl-Heinz Schmidt, Ingo Romey, Fritz Mensch: uhlí, ropa, zemní plyn: chemie a technologie. Vogel Verlag, 1981, ISBN 3-8023-0684-8 , s. 152.
- ^ Matthias Felsch: Aktion T4, první fáze eutanazie v národním socialismu , Mnichov 2003.
- ↑ Barbara Schwindt: Koncentrační a vyhlazovací tábor Majdanek: Funkční změna v kontextu „konečného řešení“ , Verlag Königshausen a Neumann, 2005, s. 161 a násl.
- ↑ JA Raub, M. Mathieu-Nolf, NB Hampson, SR Thom: Otrava oxidem uhelnatým-perspektiva veřejného zdraví . In: Toxikologie . páska 145 , č. 1 , duben 2000, s. 1–14 , doi : 10,1016 / S0300-483X (99) 00217-6 , PMID 10771127 .
- ^ Maria E. Stefanidou, Constantine P. Maravelias, Artemis A. Dona, Constantine M. Pistos, Chara A. Spiliopoulou, Sotirios A. Athanaselis: Úmrtí související s oxidem uhelnatým v Řecku. In: The American Journal of Forensic Medicine and Pathology. Svazek 33, 2012, s. 128-131, doi: 10,1097 / PAF.0b013e318252eca9 .
- ^ A b Nathaniel Cobb: Neúmyslná úmrtí související s oxidem uhelnatým ve Spojených státech, 1979 až 1988. In: JAMA: The Journal of the American Medical Association. Svazek 266, 1991, s. 659, doi: 10,1001 / jama.1991.03470050059023 .
- ↑ Jorge A. Guzman: Otrava oxidem uhelnatým. In: Kliniky kritické péče. Svazek 28, 2012, s. 537-548, doi: 10,1016 / j.ccc.2012.07.007 .
- ↑ Otrava oxidem uhelnatým v interiéru se zvyšuje. Federální institut pro hodnocení rizik, 3. února 2010, přístup 9. srpna 2014 .
- ↑ oxid uhelnatý. Citováno 29. srpna 2014 .
- ↑ Markus Fritz: Clip and clear. 100 × prostředí. Bibliographisches Institut AG, Mannheim 1977, ISBN 3-411-01706-6 , s. 18.
- ↑ a b c Ingo Wirth, Hansjörg Strauch: Soudní lékařství: Základní znalosti pro vyšetřovací praxi. Verlag Kriminalistik, 2012, ISBN 978-3-7832-0021-8 , s. 196-198.
- ^ GS Lipman: Toxicita oxidu uhelnatého ve vysokých nadmořských výškách . In: Wilderness & Environmental Medicine . páska 17 , č. 2 , 2006, s. 144-145 , PMID 16805152 .
- ↑ Kritéria environmentálního zdraví (EHC) pro oxid uhelnatý , přístup 29. listopadu 2014.
- ↑ JP Collman, JI Brauman, TR Halbert, KS Suslick: Povaha vazby O 2 a CO na metaloporphyriny a hemové proteiny. In: Proceedings of the National Academy of Sciences (PNAS). Svazek 73, č. 10, říjen 1976, s. 3333-3337, PMC 431107 (volný plný text).
- ↑ Klaus Ellinger, Harald Genzwürker (Ed.): Učebnice nouzové medicíny. Orientováno na celostátní osnovy dodatečné označení nouzová medicína. Deutscher Ärzte-Verlag, 2011, ISBN 978-3-7691-0613-8 , s. 620.
- ↑ Hu & Speizer : Environmentální a profesní rizika. Kysličník uhelnatý. In: Harrisonovy zásady vnitřního lékařství. 14. vydání. McGraw-Hill, New York City, s. 2533.
- ↑ Seznam expozičních limitů a krátkodobých hodnot. BG Bau, leden 2006, přístup 17. srpna 2014 .
- ↑ CR Henry, D. Satran, B. Lindgren, C. Adkinson, CI Nicholson, TD Henry: Zranění myokardu a dlouhodobá úmrtnost po středním až těžkém otravě oxidem uhelnatým . In: JAMA . páska 295 , č. 4 , leden 2006, s. 398-402 , doi : 10,1001 / jama.295.4.398 , PMID 16434630 .
- ^ Pokyny S1 fungují pod vlivem oxidu uhelnatého (oxidu uhelnatého) Německé společnosti pro pracovní lékařství a environmentální medicínu. In: AWMF online (od roku 2011)
- ↑ M. Coulange, A. Barthelemy, F. Hug, AL Thierry, L. De Haro: Spolehlivost nového pulzního CO-oxymetru u obětí otravy oxidem uhelnatým. In: Undersea Hyperb Med. Volume 35, No. 2, March-April 2008, pp. 107-111, PMID 18500075 .
- ^ AA Cevik et al.: Vzájemný vztah mezi PSS, hladinami CO-Hb a klinickým průběhem otravy CO v nemocnici. In: The International Journal of Clinical Practice. Vol.60 , No. 12, 2006, pp. 1558-1564, PMID 16918999 .
- ↑ Weaver a kol.: Otrava oxidem uhelnatým: rizikové faktory kognitivních následků a role hyperbarického kyslíku. In: American Journal of Respiratory and Critical Care Medicine. Svazek 176, č. 5, 2007, s. 491-497 , PMID 17496229 .
- ↑ Weaver a kol. Hyperbarický kyslík pro akutní otravu oxidem uhelnatým. In: The New England Journal of Medicine . Svazek 347, č. 14, říjen 2002, s. 1057-1067, PMID 12362006 .
- ↑ Rada pro kuřáky v lékárně - Národní program pro ukončení kouření Bern, 2008 ... 16. října 2014, přístup 30. března 2017. - HWZ: 3–6 hodin, spánek 4–8 hodin.
- ↑ Daunderer: Klinická toxikologie-plyny: oxid uhelnatý HI-4.3 33. Erg-Lfg. 1/88 (1988), přístup 30. března 2017.
- ↑ a b Cathérine Simone Gebhard : Vyšetřování regulace stimulace sekrece erytropoetinu související s oxidem uhelnatým u potkanů . Tübingen 2007, DNB 983723877 , urn : nbn: de: bsz: 21-opus-27538 (disertační práce).
- ↑ oxid uhelnatý. In: Lexikon neurologie. Citováno 29. srpna 2014 .
- ↑ P. Weydt: Receptory zprostředkované vápníkové signály v kultivovaných buňkách lidského gliomu. Tectum Verlag , 2000, ISBN 3-8288-8137-8 , s. 14.
- ^ RF Schmidt, F. Lang: fyziologie lidí. Učení a paměť. Springer-Verlag , ISBN 978-3-540-32908-4 , s. 225.
- ^ PA Berg: Syndrom chronické únavy a fibromyalgie. Springer-Verlag, 2003, ISBN 3-540-44194-8 , s. 37.
- ↑ „Dobrá“ věc na oxidu uhelnatém - imunologie: protizánětlivý účinek ve střevě. 24. prosince 2005, přístup 29. srpna 2014 .
- ^ Refaat AF Hegazi, Kavitha N. Rao, Aqila Mayle, Antonia R. Sepulveda, Leo E. Otterbein, Scott E. Plevy: Oxid uhelnatý zlepšuje chronické myší kolitidy přes hem oxygenasy 1-dependentní dráhy. In: Journal of Experimental Medicine. Svazek 202, 2005, s. 1703-1713, doi: 10,1084 / jem.20051047 .
- ↑ Atsunori Nakao, Gaetano Faleo, Hiroko Shimizu, Kiichi Nakahira, Junichi Kohmoto, Ryujiro Sugimoto, Augustine MK Choi, Kenneth R. McCurry, Toru Takahashi, Noriko Murase: Ex vivo oxid uhelnatý brání degradaci cytochromu P450 a ischemii // reperfuznímu poškození ledvin štěpy . In: Kidney International . páska 74 , 2008, s. 1009-1016 , PMID 11035334 .
- ↑ Atsunori Nakao, Augustine MK Choi, Noriko Murase: Ochranný účinek oxidu uhelnatého při transplantaci . In: Journal of Cellular and Molecular Medicine . páska 10 , č. 3 , 1. června 2006, s. 650-671 , doi : 10.1111 / j.1582-4934.2006.tb00426.x , PMID 16989726 .
- ↑ M. Baum: Měření oxidu uhelnatého na konci přílivu u žen s těhotenstvím vyvolanou hypertenzí a preeklampsií . In: American Journal of Obstetrics and Gynecology . páska 183 , č. 4 , říjen 2000, s. 900-903 , doi : 10,1067 / mob.2000.109047 , PMID 11035334 .
- ^ S. Bainbridge, E. Sidle, G. Smith: Přímé placentární účinky cigaretového kouře chrání ženy před preeklampsií: specifické role oxidu uhelnatého a antioxidačních systémů v placentě . In: Lékařské hypotézy . páska 64 , č. 1 , 2005, s. 17-27 , doi : 10,1016 / j.mehy.2004.06.019 , PMID 15533604 .
- ↑ Roberta Foresti, Mohamed G. Bani-Hani, Roberto Motterlini: Použití oxidu uhelnatého jako terapeutického činidla: sliby a výzvy . In: Intenzivní medicína . páska 34 , č. 4 , duben 2008, s. 649-658 , doi : 10,1007 / s00134-008-1011-1 , PMID 18286265 .
- ^ Y. Liu, WB Whitman: Metabolická, fylogenetická a ekologická rozmanitost methanogenní archea. In: Annals of the New York Academy of Sciences. Svazek 1125, březen 2008, s. 171-189, doi: 10,1196 / anály . 1419,019 . PMID 18378594 . (Posouzení).
- ↑ E. Oelgeschläger, M. Rother: Energetický metabolismus závislý na oxidu uhelnatém u anaerobních bakterií a archea. In: Archivy mikrobiologie. Svazek 190, č. 3, září 2008, s. 257-269, doi: 10,1007 / s00203-008-0382-6 . PMID 18575848 . (Posouzení).
- ^ W. Martin, MJ Russell: O původu biochemie v alkalickém hydrotermálním průduchu. In: Filozofické transakce Královské společnosti v Londýně. Řada B, biologické vědy. Svazek 362, č. 1486, říjen 2007, s. 1887-1925, doi: 10.1098 / rstb.2006.1881 . PMID 17255002 . PMC 2442388 (plný text zdarma). (Posouzení).
- ↑ a b Lothar Gremer, Vitali Svetlitchnyi, Ortwin Meyer: Život s oxidem uhelnatým: Biologická katalýza neobvyklých center smíšených kovů. In BioSpektrum číslo 5, 2001, 7. ročník. PDF (plný text zdarma).
- ↑ Georg Fuchs (Ed.): Obecná mikrobiologie. Založil Hans Günter Schlegel , 8. vydání. Georg Thieme Verlag, Stuttgart, New York 2007, ISBN 978-3-13-444608-1 , s. 344.
- ↑ Carboxidobacteria. In: Compact Lexicon of Biology . Spektrum.de, přístup 27. září 2014 .
- ↑ Steven Heylen, Johan A. Martens: Pokroky směrem k jednoduché chromogenní detekci oxidu uhelnatého. In: Angewandte Chemie. Svazek 122, 2010, s. 7794-7795, doi: 10,1002 / anie.201002569 .
- ↑ a b c Jürgen Fessmann, Helmut Orth: Aplikovaná chemie a environmentální technologie pro inženýry: příručka pro studium a provozní praxi. Verlag ecomed, 2002, ISBN 3-609-68352-X , s. 177-178.
- ^ AF Holleman , E. Wiberg , N.Wiberg : Učebnice anorganické chemie . 102. vydání. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , s. 488.















































