Dvojitá vazba
Dvojná vazba je forma kovalentní vazby , který zahrnuje čtyři valenční elektrony . Oba atomy jsou tak navzájem spojeny prostřednictvím dvou vazebných párů elektronů . Ve strukturních vzorcích jsou dvojné vazby reprezentovány jako dvě paralelní linie (=) mezi připojenými atomy.
Mnoho atomů může tvořit vzájemné dvojné vazby. Nejběžnější funkční skupiny nebo třídy látek s dvojnými vazbami jsou alkeny (C = C), karbonyly (C = O), sulfoxidy (S = O), iminy (C = N) a azoskupina (N = N) .
Dvojité vazby jsou silnější a kratší než jednoduché vazby. Pořadí dluhopisů je dva. Dvojné vazby jsou bohaté na elektrony, což je činí reaktivními.
Dějiny
Reprezentaci dvojné vazby dvěma dvojitými liniemi představil Joseph Loschmidt . Kolem roku 1865 představil Wilhelm von Hofmann koncovky -an, -en, -in pro označení nasycených a nenasycených alkanů.
Detailní popis

Vazebné vztahy molekuly 2. období s dvojnou vazbou lze popsat s sp 2 - hybridní orbitaly . Sousední atomy takového atomu sp 2 hybridizaci jsou v jedné rovině (molekula je rovinná). Úhly mezi vázanými atomy jsou obvykle blízké 120 ° (viz model VSEPR ), vzdálenost mezi vázajícími atomy je kolem 1,34 Å. Zbývající elektron je v orbitálu s čistým p-znakem kolmým na molekulární rovinu. Každý ze dvou atomů, které jsou spojeny dvojnou vazbou, má každý takový jednotlivě obsazený p orbitál . Kombinace těchto dvou vytváří vazbu π orbital a antibonding π * orbital.
Tento typ dvojné vazby se neomezuje pouze na 2. období, ale u dvojitých vazeb mezi prvky vyšších období se vyskytují různé vazebné vzorce. Důvodem je na jedné straně obecně nižší homonukleární vazebná energie pro větší atomy a na druhé straně nižší hybridizační tendence s a p valenčních orbitalů. V určitých případech koincidence těchto jevů znamená, že energii potřebnou k uvedení molekulárních fragmentů, které jsou základem systému dvojné vazby, do vazebného stavu již nelze aplikovat následně uvolněnou vazebnou energií. V takových případech se buď tyto fragmenty (tj. Karbeny homologní nebo analogické molekuly) získají jako izolovatelné sloučeniny, nebo k dimerizaci dochází dvojitou Lewisovou acidobazickou reakcí a výsledkem jsou dvě vazby donor-akceptor (dvojná dativní vazba). Taková dvojná vazba, kterou lze pozorovat například v případě homologů s vyšším obsahem uhlíku, lze rozpoznat podle charakteristické struktury (trans-ohnuté ohyby substituentů) a nízké energie potřebné k oddělení vazby. Disociační energie může být dokonce výrazně menší než u normální kovalentní jednoduché vazby. Typickými příklady takových systémů na dvojné vazbě jsou distannenes (R 2 Sn = SnR 2 ) a Diplumbene (R 2 Pb = PBR 2 ).
Energetická mezera mezi vazbou π a antibondingovým π * orbitálem je obvykle menší než energetická mezera mezi odpovídajícím σ a antibondingovým σ * orbitálem. V případě konjugovaných dvojných vazeb klesá excitační energie tak daleko, že viditelné světlo může stačit na zvednutí elektronu do prázdné orbity. Čím větší je počet konjugovaných dvojných vazeb, tím méně energie (světlo s delšími vlnami) je potřeba (viz také: Částice v rámečku ). V případě karotenu s jedenácti konjugovanými dvojnými vazbami je modré světlo absorbováno a molekula vypadá oranžově ( komplementární barva oranžová vzniká odečtením modré složky od vyzařovaného bílého světla).
Délky a úhly vazby
Délky vazeb dvojných vazeb mezi dvěma atomy v nekonjugovaných systémech jsou kratší než délky odpovídajících jednoduchých vazeb mezi stejnými atomy.
Délky vazeb a úhly vazeb vybraných dvojných vazeb 
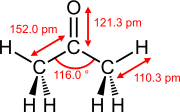

Ethen (ethylen) aceton Dimethylsulfoxid
nomenklatura
Rotace kolem dvojné vazby není snadná. Pokud mají oba vazební partneři dva různé substituenty , rozlišuje se mezi cis a trans izomery s ohledem na jejich vzájemnou polohu .
Několik dvojných vazeb, které jsou odděleny přesně jednou jednoduchou vazbou, se označuje jako konjugované , ty, které přímo sousedí s sebou, jsou kumulované a pokud existuje více než jedna jednoduchá vazba, jsou izolovány až do další dvojné vazby .
Typické chemické reakce molekul s dvojnou vazbou
- C = C dvojná vazba ( alkeny ):
-
elektrofilní adice na dvojnou vazbu
- Další (elektrofilní) molekula je buď připojena k molekule po napadení E + (E + = elektrofil) a iontovým meziproduktem, čímž dojde k rozbití dvojné vazby, nebo v případě elektrofilů s většími atomy (např. Brom ) k vytvoření kruhu ve tvaru iontového mezistupně („- oniový iont“, zde také bromoniový iont) s následným útokem na zadní stranu zbytku (v příkladu Br - ).
-
radikální přidání k dvojné vazbě
- molekula, jejíž vazbu lze snadno rozdělit homolyticky (na dva radikály) (např. chlor ), se pod světlem (UV) rozdělí na dva radikály, které pak napadají dvojnou vazbu.
-
elektrofilní adice na dvojnou vazbu
- C = O dvojná vazba ( karbonyl , keton , aldehyd , karboxylová kyselina , ester karboxylové kyseliny ):
- Redukce vazby C = O na alkoholy redukčními činidly, jako je vodík nebo Grignardovy reakce .
- Oxidace vazby C = O (pouze aldehyd) na karboxylovou kyselinu.
- Passeriniho reakce .
- C = N dvojná vazba
- Přídavek kyseliny kyanovodíkové s tvorbou α-aminonitrilů.
- Ugi reakce
- pericyklické reakce
Další reakce viz také pojmenování reakcí , kumulativní dvojná vazba .
Detekce dvojných vazeb C = C
Docela nespecifická detekce organických sloučenin s dvojnými vazbami C = C, tj. Alkenů , je možná pomocí bromové vody . Pokud je přítomen alken, bromová voda , která byla zbarvena žlutě Br2 , se po protřepání odbarví vzorkem. Bromoalkane je tvořen z alkenu pomocí adiční reakce . Podrobnosti viz detekce alkenů .
Viz také
- Pravidlo dvojité vazby
- Ekvivalent dvojné vazby
- Cis - trans izomerismus [( EZ ) izomerismus]
- π-π interakce
Individuální důkazy
- ^ Siegfried Hauptmann : Organic Chemistry , 2. přepracované vydání, VEB Deutscher Verlag für Grundstoffindindustrie, Lipsko, 1985, s. 54, ISBN 3-342-00280-8 .




