fosfor
| vlastnosti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Obvykle | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jméno , symbol , atomové číslo | Fosfor, P, 15 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kategorie prvků | Nekovy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupina , tečka , blok | 15 , 3 , s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vzhled | bílo-béžová (W) tmavě červená (R) černá (S) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Číslo CAS |
7723-14-0 (červená) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Číslo ES | 231-115-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informační karta ECHA | 100,028,286 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hmotnostní zlomek zemského obalu | 0,09% | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomový | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomová hmotnost | 30,973761998 (5) a kol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomový poloměr (vypočteno) | 100 (98) hod | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentní poloměr | 107 hod | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsův poloměr | 180 hod | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konfigurace elektronů | [ Ne ] 3 s 2 3 p 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionizační energie | 10.486 686 (15) eV ≈ 1 011.81 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionizační energie | 19. místo.76949 (4) eV ≈ 1 907.47 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionizační energie | 30.20264 (9) eV ≈ 2 914.11 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionizační energie | 51.44387 (12) eV ≈ 4 963.58 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionizační energie | 65.02511 (12) eV ≈ 6 273.97 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fyzicky | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fyzický stav | pevný | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modifikace | 6. místo | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalická struktura | ortorombický (černý) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| hustota | bílá: 1,83 g / cm 3 červená: 2,0 ... 2,4 g / cm 3 černá: 2,69 g / cm 3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| magnetismus |
diamagnetický (červený: Χ m = −1,9 10 −5 černý: = −2,9 10 −5 ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bod tání | bílá: 317,3 K (44,2 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| bod varu | bílá: 553,2 K (280 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molární objem | 17,02 · 10 −6 m 3 · mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplo odpařování | 51,9 kJ / mol (P 4 ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplo fúze | 0,64 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tlak páry | červená: 3900 Pa bílá: 3300 Pa při 293 K. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifická tepelná kapacita | červená: 685,6 J kg −1 K −1 při 298 K. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tepelná vodivost | 0,236 W m −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemicky | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidační stavy | ± 3, 4, 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativita | 2,19 ( Paulingova stupnice ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopy | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Další izotopy najdete v seznamu izotopů | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vlastnosti NMR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| bezpečnostní instrukce | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MAK |
Švýcarsko: 0,02 mg m −3 (bílý / žlutý fosfor, vdechovatelný prach ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toxikologická data |
Bílý fosfor |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Pokud je to možné a obvyklé, používají se jednotky SI . Pokud není uvedeno jinak, uvedené údaje platí pro standardní podmínky . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Fosfor (ze starořeckého φωσφόρος phōsphóros , německy „světlonosný“ , ze záře bílého fosforu při reakci s kyslíkem ) je chemický prvek se symbolem P a atomovým číslem 15. V periodické tabulce je v pátém hlavním skupina , nebo 15. IUPAC -skupina nebo skupina dusíku .
Fosfor se vyskytuje v několika, velmi odlišných modifikacích . Bílý fosfor složený z molekul P 4 je nejjednodušší na výrobu, ale termodynamicky není nejstabilnější modifikací.
Sloučeniny fosforu jsou nezbytné pro všechny živé věci a podílejí se na struktuře a funkci organismů v centrálních oblastech, jako je DNA a buněčné zásobování energií ( ADP / ATP ). Biogeochemická přeměna fosforu probíhá v rámci fosforového cyklu .
příběh




Fosfor objevil v roce 1669 německý lékárník a alchymista Hennig Brand , když odpařoval moč do sucha při hledání „ kamene mudrců “ . Když zbytek suché moči, který - jak dnes víme - také obsahuje fosfáty (soli kyseliny fosforečné), zářil pod vyloučením vzduchu - tj. V nepřítomnosti oxidačního činidla - redukce fosfátů s organickými sloučeninami také obsahovala v moči za následek v bělejší bělejší jako redukčního činidla, fosforem, které zářila ve tmě díky chemiluminiscence .
Přestože v té době nebyl fosfor používán jako noční lampa, byl vážen proti zlatu . Hennig Brand z tohoto objevu nezbohatl a recept prodal alchymistovi Johannu Danielu Kraftovi , který na oplátku na tom vydělal jmění. Produkci fosforu předvedl v roce 1677 před Robertem Boylem . Je pozoruhodné, že Hennig Brand také představil svůj Fosfor v Hannoveru vědci a filozofovi Gottfriedu Wilhelmu Leibnizovi , který z nadšení napsal báseň o tajemném nosiči světla „Phosphorus Mirabilis“.
Bílý fosfor byl původně používán jako lék kvůli své chemiluminiscenci . Po roce 1830 se stal velmi důležitým při výrobě zápalek . Protože je bílý fosfor vysoce toxický, pracovníci, kteří s ním přijdou do styku, byli často vážně otráveni. Fosforové výpary pronikaly do těla hlavně poškozenými zuby a vedly k nekróze fosforu, zejména čelisti . Fosforová čelist , anglická phossy čelist , byla jednou z prvních nemocí z povolání, která byla diagnostikována jako taková.
Bílý fosfor hrál roli jako zbraň ve vojenské historii . Používal se jako výplňový materiál pro zápalné bomby , takzvané fosforové bomby . Britské vojenské letectvo používalo během druhé světové války směs bílého fosforu a gumy . Viskózní hmota se díky gumě lepí, a proto je obtížné ji odlepit. Způsobovalo to špatně se hojící rány na kůži.
Chemici brzy zjistili, že bílý fosfor zčervenal, když byl vystaven světlu, dokonce i ve vakuu. Jöns Jakob Berzelius tušil, že se jedná o modifikaci bílého fosforu, což prokázal až v roce 1847 Anton Schrötter von Kristelli (Anton Schrötter) ve Vídni, který látku izoloval a analyzoval. Fialový fosfor objevil Johann Wilhelm Hittorf v roce 1865 . a varianta knihtisku černý fosfor Percy Williams Bridgman 1914.
Výskyt
Na Zemi, zejména v zemské kůře, se fosfor vyskytuje výhradně ve vázané formě, tj. Není nativní, většinou ve formě fosfátů (obsah v zemské kůře: ~ 0,09%, asi 1,2 kilogramu na tunu). Typickými minerály jsou apatity Ca 5 (PO 4 ) 3 (F, Cl, OH). Fluorapatit v zejména a fosforitu proloženy s uhličitanem vápenatým jsou nejdůležitější fosfáty z ekonomického hlediska. Existují i jiné minerály obsahujícími fosfor, jako je například wavellit Al 3 (PO 4 ) (F, OH) · 5 H 2 O, Vivianit Fe 3 (PO 4 ) 2 · 8 H 2 O a tyrkysový CuAl 6 [(PO 4 ) (OH 2 )] 4 · 4 H 2 O.
Největší ložiska fosfátových minerálů se nacházejí v Africe, Číně a USA ( Florida ). Čtyři země mají přibližně 80% světových zásob fosfátových hornin, které lze ekonomicky těžit pomocí současné technologie : Maroko (spolu se Západní Saharou 36,5%), Čína (23,7%), Jordánsko a Jižní Afrika (každá 9,6%). Kontinentální ložiska jsou dostačující jen na několik desetiletí; Odhady od roku 2000 se pohybují mezi 50 (2008) a 130 lety (2006). V důsledku nově nalezených ložisek hlavně v severní Africe a Iráku však odhad německé vlády z roku 2012 předpokládá, že žádný nedostatek nehrozí a že dosud známé zásoby vydrží až do roku 2400. Pod vodou jsou i velká ložiska, která ale v tuto chvíli nelze ekonomicky těžit.
Kromě minerálů se fosfor nachází také v ložiscích ptačího trusu od mořských ptáků , takzvaného guana (obsahuje 7–8%, zřídka až 60% dusičnanu chilského a maximálně kolem 40% fosfátů). To se vyskytuje hlavně na některých ostrovech v Tichém oceánu, jako je Nauru nebo Kiribati a v Jižní Americe ( Peru / Chile ). Zásoby fosforu na Nauru od poloviny 70. let nepřetržitě klesají a nyní jsou téměř úplně vyčerpány.
Čistírenský kal také obsahuje velké množství fosfátů. Kyselina fosforečná může být získán z čistírenského kalu přes městské těžby .
Z přibližně 180 milionů tun horninových fosfátů ročně vytěžených celosvětově (od roku 2010) se přibližně 90% používá na výrobu hnojiv . Fosfor nelze v hnojivech nahradit žádnou jinou látkou.
Fosfor má také důležitý význam v organickém světě (jako vázaný nebo částicově vázaný organický fosfát v organismech a v detritu ) a vyskytuje se v různých oblastech fauny a flóry : například jako hydroxylapatit Ca 5 (PO 4 ) 3 OH, který je jedním hlavních složek strukturní látky nacházející se v kostech a zubech. Sloučeniny fosforu dále hrají důležitou roli v živých organismech jako složky nukleových kyselin a jako součást energetického nosiče ATP a jsou nezbytné pro všechny známé živé bytosti.
Fosfor vzniká v hmotných hvězdách při spalování kyslíku z kyslíku při teplotách nad 1,5 · 10 9 Kelvinů a hustotách nejméně 10 10 kg / m 3 .
Předpokládá se, že fosfor použitelný pro rané živé bytosti byl k dispozici pouze prostřednictvím meteoritů, které přišly na Zemi během hadadské éry . V roce 2020 astronomové použili data z ALMA a ROSINA, aby ukázali cestu pro tvorbu fosforu: během tvorby hvězd v plynových mračnech, jako je „AFGL 5142“. Ukazují také, že se to pak mohlo dostat na Zemi prostřednictvím komet - například Churyumova -Gerasimenka - ve formě oxidu fosforečného. Fosfát, který se již vyskytuje na Zemi, je inertní a obtížně se rozpouští, a proto by byl pouze omezeně použitelný pro první živé bytosti. Naproti tomu zákoníci přinesení meteority reagují s vodou za vzniku redukovaných fosfidů . To by byly věrohodné výchozí materiály pro prebiotickou syntézu fosforylovaných biomolekul (jako je ribonukleová kyselina ).
Extrakce a prezentace
Fosfor se extrahuje z fosfátových minerálů, jako je fosforit nebo apatit , ve kterých se tyto zahřívají na 1500 ° C v elektrické tavicí redukční peci společně s křemenným štěrkem a přeměňují se tak na bílý fosfor. Pec je navržena jako uzavřená nízkošachtová pec, teplo je dodáváno pomocí Söderbergových elektrod .
Hmota uhlíku obsažená v elektrodě působí jako redukční činidlo a oxid křemičitý v křemeni působí jako struska. Fosfor vyrobený v plynné formě během procesu kondenzuje a shromažďuje se pod vodou.
Výrobce
Po bankrotu společnosti Thermphos , posledního evropského výrobce, je dodávka bílého fosforu založena téměř výhradně na společnosti Kazphosphate , která provozuje závod v Tschimkentu . Dalšími výrobci jsou Monsanto se závodem v Soda Springs ( Idaho ) a různé čínské společnosti.
Úpravy a vlastnosti
Fosfor se vyskytuje ve čtyřech alotropických modifikacích jako bílý, červený, černý a purpurový fosfor. Každý z těchto základních typů tvoří různé krystalické struktury . To vede k velmi velkým rozdílům ve fyzikálních vlastnostech a reaktivitě.
Protože ostatní modifikace je obtížné získat přímo, vždy se nejprve vyrobí bílý fosfor a ten se poté převede na další modifikace. Ty lze navzájem převést vysokým tlakem a vysokou teplotou. Černý fosfor je ve skutečnosti nejstabilnější modifikací při pokojové teplotě, ale ostatní jsou metastabilní kvůli pomalé rychlosti přeměny . Bílý fosfor lze vyrobit v laboratoři zahříváním červeného fosforu v nepřítomnosti kyslíku. Naopak červený fosfor může být také produkován zahříváním bílého fosforu na přibližně 180-350 ° C po dobu několika hodin.
Plynný stav
V parách fosforu převažují tetraedry CP 4 jako nejmenší molekulární jednotky pod 1200 ° .
Vzdálenost PP v tetraedrických molekulách P 4 je r g = 2,1994 (3) Å, úhel PPP je 60 °. Struktura byla určena difrakcí plynových elektronů .
Stupeň disociace je ~ 1% při 800 ° C Mezi 1200 a 2 000 ° C převládají molekuly P 2 s dusičitou analogickou valenční elektronovou strukturou, nad 2 000 ° C se nakonec pomalu zvyšují teploty s atomovým fosforem.
Bílý fosfor
Bílý fosfor je nejtěkavější a nejreaktivnější modifikací fosforu. Má hustotu 1,82 g / cm 3 , teplotu tání 44,25 ° C a teplotu varu 280 ° C a je průsvitný a voskovitý. Při kontaminaci je bílý fosfor známý také jako žlutý fosfor . Kubická bílý fosfor je velmi snadno rozpustný v chloridu fosforitého a oxidu sulfidu CS 2 ; 100 g sirouhlíku rozpustí více než 1 kg fosforu. Fosfor je mírně rozpustný v tetrachlormethanu , benzenu nebo etheru . Je prakticky nerozpustný ve vodě.
Při teplotě –76,9 ° C se kubický tvar (tvar α) mění na hexagonální (tvar β) (rotace volných vnějších elektronů „zamrzne“). V jakékoli formě (α-, β-, v roztoku) tvoří bílý fosfor čtyřstěn P 4 s úhlem vazby 60 °.
V jemně rozděleném stavu se bílý fosfor sám vznítí ve vzduchu, od přibližně 50 ° C se zapalují a hoří za vzniku oxidu fosforečného (V) dokonce i kompaktní kusy . Proto musí být bílý fosfor držen pod vodou. Hořící fosfor se nesmí hasit vodou, protože hrozí, že se fosforový prach vypere do jemných trhlin a po odpaření vody se znovu vznítí. Hořící fosfor je nejlépe uhasit pískem.
Bílý fosfor může ve vzduchu vykazovat namodralou chemiluminiscenci . To vyplývá z plynné P 4, v prostředí v důsledku vysokého tlaku par bílého fosforu , který reaguje na P 4 O 10 až oxidace v plynné fázi přes P 4 O 6 . Obvykle v prudké exotermické reakci se fosfor kombinuje s halogeny, kovy nebo sírou. Výslednými sloučeninami jsou sulfidy fosforu , sloučeniny fosforu (III) nebo fosforu (V) a fosfidy . Působením silných zásad při vysokých teplotách se fosfor disproporcionuje na fosfin a hypofosforitan. Fosfor má vysokou afinitu ke kyslíku , takže má silný redukční účinek . Takže z. B. Kyselina sírová se po zahřátí bílým fosforem redukuje na oxid siřičitý .
Oxid fosforečný, který vzniká při spalování fosforu, je vysoce hygroskopický a se vzdušnou vlhkostí tvoří hustou mlhu kyseliny fosforečné. Bílý fosfor se proto používá v kouřových granátech.
Bílý fosfor je vysoce toxický; pouhých 50 mg může být pro dospělého člověka smrtelné. Smrt nastává až po pěti až deseti dnech. Bílý fosfor se také jen pomalu vylučuje. Díky pomalé toxicitě je (e) fosfor vhodný jako krysí jed . K tomuto účelu byly používány takzvané „Phosphorlatwergen“. Vzhledem k obecnému nebezpečí a protože jsou k dispozici vhodnější činidla, je bílý fosfor zastaralý jako jed na krysy.
Toxicita bílého fosforu je přičítána především jeho vysoké redukční síle , která narušuje intracelulární oxidační metabolické procesy, jako je syntéza bílkovin a sacharidů. To se týká hlavně enzymaticky řízených metabolických procesů v játrech. Další nebezpečí představují vysoce jedovaté fosfiny vznikající reakcí s vodou , které jsou silnými metabolickými jedy a mají zvláštní afinitu k centrálnímu nervovému systému . Bílý fosfor lze zneškodnit roztokem síranu měďnatého. Přitom se tvoří málo rozpustný fosfid mědi (I) .
Od roku 1845 patřili mezi dělníky, hlavně v průmyslové výrobě zápalek těžkých s bílým fosforem, pozorována čelist - nekróza ( anglická phossy čelist ). V 19. století dělníci, kteří zcela nechráněně manipulovali s fosforovými koupelemi (často také děti a mládež, kteří měli plné ruce práce s balením zápalek), rychle nemohli pracovat. Žádná účinná terapie neexistovala. Pacienti byli těžce znetvořeni, často nezaměstnaní, úmrtnost byla 20%. Pracovně lékařský problém nekrózy fosforu , zejména masivní nekrózy borovice, vedl k prvním pracovně lékařským důsledkům v historii moderní medicíny. V roce 1906 Bernská úmluva vedla k zákazu bílého fosforu při výrobě zápalek. Podobnou nekrózu čelisti lze dnes pozorovat při léčbě bisfosfonáty ( nekróza kostí spojená s bisfosfonáty ).
Černý fosfor
Nejstabilnější modifikace při pokojové teplotě existuje v jedné amorfní a třech krystalických formách. Vzhledem ke své polymerní formě, černý fosfor je nerozpustný, podstatně méně hořlavý, velmi inertní a má hustotu 2,69 g / cm 3 . Proto, stejně jako červený fosfor, černý fosfor není toxický. Krystalová mřížka, na které je založen černý fosfor, se skládá z vlnitých dvojitých vrstev, ve kterých jsou atomy fosforu pyramidálně spojeny se třemi dalšími atomy fosforu v okolí pod úhlem vazby 100 °. V této konfiguraci má fosfor polovodivé vlastnosti . Ve vlhkém vzduchu se černý fosfor oxiduje o něco rychleji než červený fosfor, ale je pokryt bezbarvou, viskózní tekutou kůží vyrobenou z kyselin fosforečných, takže je zabráněno dalšímu přístupu kyslíku a ztížen zánět. Normální černý fosfor krystalizuje ortorombicky ; při 80 000 barech se to reverzibilně změní na kosočtverečný a při 110 000 barech na krychlovou metalickou úpravu.
Černý fosfor vzniká z bílého fosforu pod vysokým tlakem (12 000 barů) a zvýšenou teplotou (200 ° C) a svou barvou se velmi liší od výše uvedené modifikace. Vypadá šedo-černé, lesklé a vláknité jako dřevo. Nedávno byla také provedena úprava nízkého tlaku.
Červený fosfor
Řada amorfních a krystalických forem s variacemi hustotou mezi 2,0 a 2,4 g / cm 3 a teploty tání mezi 585 ° C a 610 ° C, jsou seskupeny pod označením červený fosfor . Červený fosfor je obecně amorfní, ale lze jej převést na monoklinický hittorfiánský (fialový) fosfor rekrystalizací z roztaveného olova , které tvoří trojrozměrně zesíťovanou polymerní formu.
Červený fosfor se získává zahříváním bílého fosforu na přibližně 260 ° C po dobu několika hodin v nepřítomnosti vzduchu. K pomalému převodu dochází také při vystavení světlu. Jód katalyzuje přeměnu bílého na červený fosfor.
Rozdíly mezi krystalickými částmi v červeném fosforu určují jejich různé formy. Vliv zde má velikost zrna , typ mřížky , nečistoty a různé nasycení okrajových skupin halogeny , kyslíkem a hydroxylovými skupinami .
Přestože červený fosfor není samozápalný, může být způsoben náhlým vzplanutím nebo dokonce explozí silnými oxidačními činidly díky nízkému energetickému příkonu (tření, náraz). Příkladem toho je Armstrongova směs , která se používá k úderům bezpečnostních zápasů. Pokud jde o reaktivitu, fialový fosfor je spíše jako černý fosfor, zatímco Schenckův fosfor je mnohem reaktivnější než „normální“ červený fosfor.
Na rozdíl od bílého fosforu není červený fosfor toxický. Jeho první popis je přičítán Antonovi Schrötterovi von Kristelli .
Jasně červený fosfor
Světle červený neboli Schenckův fosfor ( Rudolf Schenck , 1902) se vyrábí vařením bílého fosforu v bromidu fosforečném (PBr 3 ). Produkt je smíšená sloučenina fosforu s 10 až 30% bromu, hustota, což je 1,88 g / cm 3 .
Fialový / Hittorfův fosfor
Fialový fosfor vzniká, když se bílý fosfor zahřívá jeden až dva týdny na přibližně 550 ° C.
Objevil ho Johann Wilhelm Hittorf . Je to nevodivý polymer, který je nerozpustný v CS 2 . Struktura objasnění uspěl v pozdní 1960 na univerzitě ve Stuttgartu od Herberta Thurn . Fialový fosfor je také netoxický.
Nanorodky fosforu
V srpnu 2004 se německým vědcům podařilo izolovat a strukturálně charakterizovat dvě další modifikace mnohostranného prvku: nanorodky fosforu . V těchto dvou modifikacích jsou atomy fosforu ve formě řetězcových molekul (polymerů). Objeviteli nových úprav jsou Arno Pfitzner z Univerzity v Řezně a Hellmut Eckert z Vestfálské Wilhelmsovy univerzity v Münsteru . Červenohnědá vlákna, která se výrazně liší od modifikace červeného fosforu, jsou v suchém stavu stabilní po několik týdnů na vzduchu. Elektronová mikroskopie ukázala tuto červenohnědou formu fosforu jako dlouhé, paralelní nanorody s průměrem přibližně 0,34 nm (nanometry) až 0,47 nm.
Izotopy
Fosfor má pouze jeden stabilní izotop , 31 P; toto je jediný přirozeně se vyskytující izotop fosforu. Jedná se tedy o čistý prvek (anizotopický).
Fosfor má několik dalších izotopů, z nichž všechny jsou radioaktivní. Izotop fosforu 33 P má nejdelší poločas rozpadu s 25,3 dny . 32 P má poločas rozpadu 14,3 dne a používá se v medicíně. Používá se také jako indikátor v molekulární biologii . Lze jej použít například k radioaktivnímu označení genových sond a k jejich detekci pomocí autoradiografie .
použití
Většina (80%) vyrobeného bílého fosforu se spaluje za vzniku oxidu fosforečného ( P 2 O 5 ), který se používá jako výchozí materiál pro výrobu kyseliny fosforečné a pro přípravu různých fosfátů . Naproti tomu většina všech fosfátů se používá jako hnojiva . Oxid fosforečný je také důležitý jako jedna z nejúčinnějších dehydratačních látek ( sušidel ).
Další část se týká chloridu fosforitého (PCl 3 ) a sulfidu fosforečného ( zpracovaného P 4 S 10 ) jako základního materiálu pro výrobu zpomalovačů hoření , aditiv , změkčovadel a pesticidů .
K výrobě zápalek se používá červený fosfor . Jemně rozdělený červený fosfor se paradoxně také přidává do plastů (např. Polyamid ) jako zpomalovač hoření: reakční produkty fosforu, atmosférického kyslíku a vody (vlhkost, zbytková vlhkost v plastu) vytvářejí proti plamenům zuhelnatělou ochrannou vrstvu. Kromě toho působí vytvořené suboxidy fosforu, např. B. PO, jako lapač radikálů a tímto způsobem přeruší spalování v plynné fázi.
Kromě toho jsou fosfáty, které jsou důležité jako hnojiva, získávány přímo z fosforečnanu vápenatého rozštěpením kyselinou sírovou . Vyrábí se takzvaný superfosfát . K tomu je zapotřebí přibližně 60% světové produkce kyseliny sírové.
Červený a bílý fosfor se také používají pro vojenské účely. Velmi jedovatý a samozápalný bílý fosfor se používá v zápalné munici, jako jsou fosforové bomby, a dříve se používal také v kouřové munici. V moderní kouřové munici se však netoxický červený fosfor používá ve směsích s oxidačními činidly a kovovými palivy. Pokud je cílem mlha, pokusí se získat co nejjemnější prach z P 2 O 5 , jehož každá částice působí hygroskopicky jako kondenzační jádro pro vzdušnou vlhkost. Mlha se pak skládá z malých kapiček zředěné kyseliny fosforečné, což je dosti slabá kyselina.
Do 80. let 20. století se ve školách také experimentovalo s bílým fosforem, což bylo ze zdravotních důvodů zakázáno. Nyní může být v experimentech použit pouze červený fosfor.
Izotop radioaktivního fosforu 32 P se používá v medicíně a ve výzkumu jako indikátor k pozorování metabolických procesů (například při označování 32P po značení ) nebo k léčbě nemocí, například při terapii polycythemia vera v nukleární medicíně . Zastaralým způsobem diagnostiky choroidálního melanomu byl radiofosforový test .
V zemi
Fosfor vstupuje do půdy přirozeně prostřednictvím apatitického zvětrávání nebo z rozložené organické hmoty. Atmosférická depozice hraje s fosforem pouze podřízenou roli. Fosfor je důležitou základní živinou . U umělých hnojiv lidé zvyšují obsah fosforu v půdě. Za hlavní faktor ztrát lze považovat erozi. Přímé vyluhování do podzemních vod je velmi nízké a kromě zanedbatelného množství plynného fosfinu nedochází k odplyňování z půdy. Fosfát má velmi špatnou rozpustnost . Například adsorpce na hydroxidy Fe a Al v kyselých půdách vede k fixaci fosfátu. Srážení s vápníkem se vyskytuje v zásaditých půdách .
Fosfátové frakce v půdě lze obecně klasifikovat různými způsoby. Dvě často používané klasifikace jsou klasifikace podle rozpustnosti a klasifikace podle typů fosfátů.
Klasifikace tří různých fosfátových frakcí v půdě podle rozpustnosti:
- Fosfát dostupný v půdním roztoku je přímo k dispozici rostlinám. Jedná se však o nejmenší podíl 1–2 kg / ha.
- Nestabilní fosfát je specifickou sorpcí volně vázán na oxidy železa a hliníku nebo na jílové minerály. V půdě tak může být přítomno 450–900 kg / ha. Absorpcí lze z této frakce vytvořit fosfát dostupný v rostlinách.
- Stabilní fosfát nemá pro výživu rostlin prakticky žádný význam, přestože s 3 000–6 000 kg / ha je největší ze tří frakcí. Nejdůležitějšími zástupci zde jsou apatity a fosforečnany vápenaté.
Tyto zlomky jsou ve vzájemné dynamické rovnováze a někdy se mohou navzájem sloučit po velmi dlouhou dobu.
Klasifikace tří různých fosfátových frakcí v půdě podle typů fosfátů:
- Anorganický fosfát je frakce, která je přítomna v primárních minerálech fosforu (např. V apatitu ), v sekundárních minerálech fosforu ( minerály Fe , Al nebo Ca ) nebo je adsorbována na hydroxidy Fe a Al .
- Rozpuštěný fosfát je podíl, který je v rozpuštěné formě přítomen v půdním roztoku jako H 2 PO 4 - nebo jako HPO 4 2− . Rozpuštěný fosfát je přímo k dispozici rostlinám.
- Organický fosfát je souhrnný termín pro všechny ostatní organické sloučeniny, které jsou přítomny v půdě. To zahrnuje fosfor v humusu, fosfor adsorbovaný na organických molekulách, mikrobiální fosfor a fosfor v rostlinných zbytcích.
Časový okamžik, kdy je dosaženo maximální globální produkce fosfátů, je znám jako Peak Phosphorus .
Biologický význam
fyziologie
Fosfor je nezbytný pro všechny biologické organismy. Sloučeniny fosforu jsou součástí molekul DNA a RNA , nosné látky pro genetickou informaci všeho živého. Adenosintrifosfát s vysokým obsahem fosforu hraje klíčovou roli v energetickém metabolismu (aktivovaný cukr) buněk. Fosfor je také obsažen v cukrových fosfátech, fosfolipidech a koenzymech . Fosforylace je klíčovým regulační mechanismy v organismech. Fosfáty jsou také nedílnou součástí systému pufru pH v krvi .
Sušina suchozemských rostlin obsahuje 0,15% až 0,50% fosforu, u savců, jako jsou lidé, asi 4%. Kostru kostí a zubů tvoří převážně hydroxyapatit (Ca 5 (PO 4 ) 3 OH). Tělo osoby o hmotnosti 70 kg obsahuje přibližně 700 gramů fosforu, z nichž 600 g je pevně vázáno v kostním systému.
Denní potřeba dospělého člověka je asi 0,75 gramu fosforu; Obzvláště bohatý je na mléčné výrobky, maso, ryby a chléb. Dostupnost fosfátu často působí jako omezující růstový faktor pro rostliny, a proto je třeba v zemědělství aplikovat velké množství hnojiv obsahujících fosfát.
Bílý fosfor a sloučeniny fosforu, jako je fosfin a četné estery kyseliny fosforečné, jsou velmi toxické.
rostliny
Fosfor plní v rostlinách různé základní funkce. Je součástí lipidů a je tedy strukturálním prvkem. V DNA a RNA je mostem mezi dvěma ribózami . Kovalentně vázaný na adenosin slouží jako univerzální forma přenosu energie v buňkách. Kromě toho má fosfor vliv na rovnováhu uhlohydrátů, fotosyntézu a vodní rovnováhu rostlin.
Aby byl fosfor nacházející se v půdě dostupný pro metabolismus, musí rostliny uvolňovat organicky nebo anorganicky vázaný fosfor, který mohou absorbovat jako H 2 PO 4 - . Totéž platí pro mikroorganismy a houby, které žijí v půdě. Mnoho mikroorganismů, hub a rostlin uvolňuje do půdy enzymy, které hydrolyzují organické estery kyseliny fosforečné a uvolňují tak anorganický fosfát, který mohou organismy absorbovat a metabolizovat. Tyto enzymy se nazývají fosfatázy . V závislosti na optimálním rozmezí pH fosfatázy se rozlišuje mezi kyselými (pH 4–5) a zásaditými fosfatázami. Pokud rostlina absorbuje více fosfátu, než může použít v lipidech, nukleových kyselinách, a naváže se na adenosin, přebytek uloží jako organicky vázanou formu do vakuol . Fosfatázy také v tomto bodě pomáhají přeměnit fosfát zpět na anorganickou volnou formu.
Pokud rostliny trpí nedostatkem fosfátů, vykazují různé příznaky. Listové plochy se zmenší a celkově se sníží habitus; může dojít k zabarvení antokyanů a může dojít k nekróze. Díky akumulaci škrobu v chloroplastech listy „ztuhnou“. Vývoj květů, semen a plodů je omezen nebo zpožděn. Vzhledem k tomu, že syntéza chlorofylu není nedostatkem fosfátů tolik snížena, protože se zmenšuje podíl listové plochy, dochází v listech k hyperchlorofylaci, která je vyjádřena sytě zelenou barvou.
Protože je koncentrace fosfátů v rhizosféře značně snížena, zejména v oblasti jednoho až dvou mm kolem kořenů, reagují některé rostliny na nedostatek fosfátů zvýšeným růstem kořenů.
ekologie
Cyklus fosforu nebo cyklus fosforu je neustálá migrace a biogeochemická přeměna biologického prvku fosforu ve vodě, v půdách a v biomase.
Vzhledem k ústřednímu ekologickému významu fosfátu hraje kvantitativní analýza fosforu také důležitou roli v praxi chemického monitorování vody a půdy, například při určování kontaminace fosfáty (zvýšené koncentrace fosfátů) ve vodě z přehnojených zemědělských oblastí v plocha.
důkaz
Spektroskopicky
Metodou volby pro detekci sloučenin fosforu je 31 P NMR spektroskopie. 31 P je jediným přirozeně se vyskytujícím izotopem fosforu a má kvantové číslo jaderného spinu 1/2. Ve srovnání s vodíkem je relativní citlivost pouze 6,6%. Rozsah rezonance je přibližně 700 ppm (například P 4 má posun o -520 ppm). Jako standard lze použít 85% kyselinu fosforečnou. Vzhledem k tomu, že fosfor je spin 1/2 jádro, lze spektra vyhodnotit velmi dobře. Pokud je vodík také odpojen, obvykle vznikne ostrý signál. Posun fosforu je vysoce závislý na jeho vazebném partnerovi, takže je velmi vhodný pro identifikaci známých sloučenin. V případě neznámých sloučenin je informativní hodnota často omezená, protože jednu třídu sloučenin lze jen výjimečně přiřadit výhradně spektrálnímu rozsahu.
| Deriváty s | Chemický posun (δ v ppm) |
|---|---|
| 3-strunný P | −180 až +200 |
| 4-strunný P | −120 až +130 |
| 5-strunný P | −100 až −20 |
| 6strunný P | −220 až −130 |
Mokrá chemikálie
Kvantitativní a kvalitativní stanovení fosforu probíhá prostřednictvím fosfátu ( přesněji ortofosfátu PO 4 3− ). Za tímto účelem je vázaný fosfor přeměněn na fosfát oxidačním štěpením, je -li to nutné .
Kvalitativní důkazy
Při detekční reakci s molybdenanem sodným se získá žlutý roztok molybdenofosfátu sodného v kyselém roztoku ; k roztoku se přidá barevné činidlo vyrobené z rozpuštěné kyseliny askorbové a zahřívá se ve vodní lázni. Výsledkem je molybdenová modř , kterou lze stanovit kvantitativně a fotometricky.
Při detekční reakci s heptamolybdenanem amonným se v kyselém roztoku získá žlutá sraženina molybdofosfátu amonného . Vezmeme -li v úvahu, že heptamolybdenan vstupuje do rovnováhy ve vodném roztoku:
vyplývá z následující reakční rovnice:
V alkalickém roztoku amoniaku fosfátu padá v přítomnosti hořčíku - ionty jako fosforečnan hořečnato-amonný z:
Důkaz lze také provést ve formě hydrogenfosforečnanu zirkoničitého :
Jak je uvedeno v mnoha učebnicích, forma Zr 3 (PO 4 ) 4 je nesprávná; tato sloučenina se netvoří ve vodných roztocích!
Historicky je vzorek Mitscherlicha zajímavý pro detekci bílého fosforu, který byl primárně používán při podezření na otravu fosforem. Obsah žaludku se zahřeje vodou a bílý fosfor, který je těkavý s vodní párou, pak kondenzuje a při kontaktu s atmosférickým kyslíkem se rozsvítí ( chemiluminiscence ).
Pro studium struktury sloučenin, které obsahují fosfor, 31 P nukleární magnetickou rezonanční spektroskopii , je vhodný .
Kvantitativní důkazy
Gravimetrie
Pro gravimetrické stanovení lze z iontů fosfátu a molybdenanu v silném roztoku kyseliny chlorovodíkové vytvořit žlutý molybdenofosfátový iont :
S 8-hydroxychinolinu ( zvané HOX nebo oxin pro krátký ), málo rozpustné sraženiny oxin-12-molybdo-1-fosfátu se tvoří, který se potom suší při teplotě 160 ° C a zváží se v bezvodé formě.
- Forma srážek:
- Forma vážení:
- (Barva: tmavě oranžová)
Hrubě krystalická sraženina obsahuje pouze 1,37% fosforu. To znamená, že zejména menší množství fosfátu lze snadno určit (viz mikromolová metoda ).
Volumetrie
Volumetrické fosfátové stanovení jsou srážky s La 3+ nebo Bi 3+ - standardní roztoky a následná zpětná titrace s EDTA provedeny.
Kolorimetrie / fotometrie
Pro stanovení nízkých koncentrací fosfátu ve sladkovodních vzorcích se vytváří tmavomodrý komplex molybdenanu antimonu a fosforu, kterému je jeho intenzivní barva dána pouze redukčním činidlem, obvykle kyselinou askorbovou . To umožňuje citlivé nátisky až do rozmezí přibližně 0,6 mg PO 4 / l (přibližně 0,2 mg P / l).
Postup je standardizován v EN ISO 6878 (dříve EN 1189 nebo DIN 38405 D11).
bezpečnostní instrukce
Bílý fosfor
Bílý fosfor se může ve vzduchu vznítit, pokud je jemně rozdělen. Teplota samovznícení se pohybuje kolem 34 ° C, což je relativně blízko pokojové teplotě. Reakce na oxid fosforečný je silně exotermická . Toxické fosfiny mohou být tvořeny vodou a hydroxidy alkalických kovů . Silná oxidační činidla obvykle reagují výbušně.
Likvidace munice obsahující fosfor po druhé světové válce v mělkých částech Baltského moře opakovaně vede k vážným zraněním a úmrtím. Jantarově zbarvené hrudky fosforu jsou vyplaveny a ohrožují tím zejména rybáře a turisty. Podle statistik zemřelo po druhé světové válce v Baltském moři na zbytky munice 168 lidí a 250 lidí bylo zraněno, někteří vážně. Odborníci nyní dokonce předpokládají, že čísla jsou výrazně vyšší.
Akutní otrava bílým fosforem (otrava fosforem ) se projevuje gastrointestinálními poruchami, poškozením jater s těžkými metabolickými poruchami a poškozením srdce a ledvin. Chronická otrava vede i v malém množství k narušení celkového stavu a poškození krve a kostí ( osteoporóza ), zejména čelisti.
Dávky 15 mg nebo více bílého fosforu mohou způsobit závažné toxické účinky. Částky od 50 mg (~ 1 mg / kg tělesné hmotnosti) mohou být smrtelné .
Školní experimenty s bílým fosforem, jako například experiment s fosforovým zvonem , nejsou podle novějších předpisů povoleny; bílý fosfor nesmí být ve školách skladován kvůli jeho nebezpečnosti.
Další úpravy
Ostatní známé modifikace fosforu jsou ve své čisté formě netoxické, protože jsou nerozpustné ve vodě a mají nižší reaktivitu. Také se zapalují pouze při vyšší teplotě (červený fosfor pouze při 260 ° C).
Odkazy
Fosfor je velmi reaktivní a vytváří kovalentní vazby s velkým počtem nekovů . Vyskytuje se ve všech oxidačních stavech mezi −3 a +5 a koordinačními čísly 1 až 6, většinou 3 až 4. Oxidační čísla -3 a +5 jsou výhodná.
Sloučeniny vodíku
Fosfany (starý název fosfin již nevyhovuje IUPAC , ale používá se téměř výhradně v chemické literatuře, zejména v anglosaském) označují sloučeniny trojmocného fosforu vodíkem nebo nahrazení jednoho nebo více atomů vodíku organickými skupinami jako vazebných partnerů . Organická skupina musí být připojena přímo k atomu fosforu prostřednictvím atomů uhlíku v páteři. Pokud je organická skupina vázána na atom fosforu atomem kyslíku (tj. Jednotkou POC, např. V P (OPh) 3 ), hovoří se o esterech kyseliny fosforečné nebo fosfitech .
Oxidy
S kyslíkem tvoří fosfor různé sloučeniny obecného vzorce P 4 O n (n = 6–10, 18), protože fosfor může být přítomen v několika oxidačních stavech. Jsou možné jednoduché vazby a dvojné vazby fosfor-kyslík, jakož i přemosťující vazby fosfor-kyslík-fosfor.
Oxidy fosforu tvoří struktury podobné adamantanu :
- Oxid fosforečný P 4 O 6 je bílá, měkká sloučenina, která je velmi toxická a reaktivní a rychle reaguje za vzniku oxidu fosforečného.
- Oxid fosforečný P 2 O 4 je směsný oxid. Lze jej získat oxidací oxidu fosforečného na chlorid uhličitý .
- Oxid fosforečný P 4 O 10 je nejdůležitější oxid fosforečný. Je velmi hygroskopický a používá se jako sušicí činidlo.
Existují také další oxidy fosforu, které nelze za normálních podmínek izolovat. Z nich je oxid uhelnatý PO pravděpodobně nejběžnější molekulou obsahující fosfor v mezihvězdných oblacích .
Oxokyseliny a soli
Z těchto oxidů lze odvodit velké množství kyselin fosforu a kyslíku a jim odpovídajících solí s jedním nebo více atomy fosforu:
| Úroveň oxidace fosforu |
Strukturní vzorec | Název kyseliny | Název solí | |
|---|---|---|---|---|
| Kyseliny monofosforečné | ||||
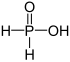
| + Já | Kyselina fosfinová | Fosfináty | ||
| + III | Kyselina fosfonová | Fosfonáty | ||
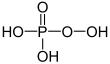
| + V | kyselina fosforečná | Fosfáty | ||
| + V | Kyselina peroxomonofosforečná | Peroxomonofosfáty | ||
| Difosforečné kyseliny | ||||
| + II | Kyselina hypodifosfonová | Hypodifosfonáty | ||
| + III | Kyselina difosfonová | Difosfonáty | ||
| + IV | Kyselina hypodifosforečná | Hypodifosfáty | ||
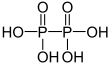
| + V | Kyselina difosforečná | Difosfáty | ||
| + V | Kyselina peroxodifosforečná | Peroxodifosfáty | ||
Existují také deriváty těchto kyselin obsahující síru , např. B. kyselina thiofosforečná , jejíž soli se nazývají thiofosfáty .
Existuje také řada minerálů fosforu , z nichž nejdůležitější jsou hydroxyapatit a fluoroapatit . Další fosforové minerály najdete v kategorii: minerální fosfor .
Halogenové sloučeniny
Fosfor tvoří velké množství sloučenin s halogenidy fluoru , chloru , bromu a jódu . Nejdůležitějšími typy připojení jsou PX 3 , P 2 X 4 a PX 5 . Sloučeniny fluoru jsou plynné, sloučeniny chloru jsou většinou kapalné, sloučeniny bromu a jodu jsou pevné. Mnoho sloučenin halogenů fosforu je jedovatých. Všechny sloučeniny jsou citlivé na hydrolýzu a během skladování musí být chráněny před vlhkostí.
Příklady této třídy sloučenin jsou chlorid fosforitý , chlorid fosforitý , tetrafluorid difosforečný a trijodid fosforitý . Sloučeniny halogenu kyslíku a síry typu POX 3 (např. Oxychlorid fosforečný ) a PSX 3 , jakož i halogenidy polymerních oxidů typu (POX) n jsou také známé . Halogenidy fosforu patří mezi první nekovové halogenidy, které na počátku 19. století zkoumali vědci jako Joseph Louis Gay-Lussac , Humphry Davy a Pierre Louis Dulong .
Jiné anorganické sloučeniny
Fosfor a síra tvoří řadu sulfidů fosforu, které ve své struktuře z. T. připomínají sloučeniny fosforu a kyslíku . Struktura je založena na čtyřstěnu P 4 , okraje a špičky čtyřstěnu jsou obsazeny odlišně atomy síry. Mají obecný vzorec P 4 S x (x = 3–10). Jsou vyráběny zahříváním červeného fosforu a síry v příslušných poměrech. Sulfid fosforečný (P 4 S 10 ) je nejdůležitější z nich. Trisulfid tetrafosforu (P 4 S 3 ) se stále částečně používá pro zápalný materiál zápalek . Sloučeniny se selenem jsou také známé.
Dusík a fosfor tvoří nitridy složení PN a P 3 N 5 . Chloridy nitrilu fosforu (dichloridy nitrilu fosforu) nejsou v monomerním stavu známy. Mají obecný vzorec (PNCl 2 ) x s kruhovou nebo řetězcovou strukturou. Vznikají reakcí chloridu amonného s chloridem fosforitým a patří do skupiny fosfazenů, sloučenin obecného vzorce (PNH 2 ) x . Polydichlorfosfazen má vlastnosti jako syntetický kaučuk , ale je nestabilní. Nahrazením atomů chloru alkoxyskupinami nebo perfluoralkoxyskupinami se však získají chemicky a tepelně stabilní polymery s elastomerními vlastnostmi.
Organické sloučeniny

Mezi organickými sloučeninami fosforu lze rozlišovat sloučeniny s vazbou fosfor-uhlík a sloučeniny bez vazby fosfor-uhlík. Mezi první patří deriváty fosfinů, ve kterých jsou atomy vodíku nahrazeny jedním nebo více organickými radikály. Tato skupina zahrnuje také fosfinoxidy (R 3 PO), alkylphosphinic kyselin (R 2 PO (OH)) a alkylfosfonové kyseliny (R-PO (OH) 2 ), nebo jejich soli. Příklady druhé skupiny jsou estery z kyseliny fosfinové , fosfonové nebo kyseliny fosforečné , které jsou označované jako fosfity , fosfonáty a fosfáty . Organické sloučeniny fosforu - například trifenylfosfin , fenyldichlorfosfin nebo fosforylidy - hrají roli v mnoha organických reakcích, např. B. Wittigova reakce hraje důležitou roli.
V biochemii jsou zvláště důležité estery kyseliny fosforečné . Jsou životně důležitou součástí mnoha metabolických procesů a součástí DNA . Důležité molekuly jsou:
literatura
- John Emsley: Fosfor - prvek života a smrti . Weinheim 2001, ISBN 3-527-30421-5 .
- Harry H. Binder: Lexikon chemických prvků - periodická tabulka faktů, čísel a dat . Hirzel, Stuttgart 1999, ISBN 3-7776-0736-3 .
- F. Krafft: Fosfor. Od lehké hmoty k chemickému prvku. In: Angewandte Chemie . 81 (17/18), 1969, s. 634-645; doi: 10,1002 / anie.19690811703 .
- Ludwig Maier: Sloučeniny fosforu a jejich technický význam. In: Chemie v naší době . 9. ročník, č. 4, 1975, s. 109-116; doi: 10,1002 / ciuz.19750090403 .
- Jochen Metzger: Fosforová časovaná bomba. Pokud dojde tato surovina, hrozí apokalypsa. In: PM svět znalostí. Č. 8, 2010, ISSN 1863-9313 , s. 58-64.
webové odkazy
- Německá fosforová platforma DPP eV - Síť na podporu obnovy fosforu a udržitelného využívání regenerovaných produktů
- CEEP Phosphates Webové stránky TU-Darmstadt a CEEP pro obnovu fosforu
- Fosforová krize - konec lidstva? TV dokument od arte , květen 2013, režie Christiane Schwarz a Marcel Weingärtner
- Rezervy fosfátů Přednáška o globálních rezervách, těžbě, spotřebě a vývoji cen (PDF; 3,3 MB)
Individuální důkazy
- ↑ a b Harry H. Binder: Lexikon chemických prvků. S. Hirzel Verlag 1999, ISBN 3-7776-0736-3 .
- ↑ Hodnoty vlastností (informační pole) jsou převzaty z www.webelements.com (phosphor) , pokud není uvedeno jinak .
- ^ IUPAC, Standard Atomic Weights Revised 2013 .
- ↑ a b c d e Záznam o fosforu u Kramida, A., Ralchenko, Yu., Reader, J. a NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1) . Ed.: NIST , Gaithersburg, MD. doi : 10.18434/T4W30F ( https://physics.nist.gov/asd ). Citováno 11. června 2020.
- ↑ a b c d e Záznam o fosforu na WebElements, https://www.webelements.com , přístup 11. června 2020.
- ↑ b c d e f vstup na tetraphosphorus (bílý fosfor) v databázi GESTIS látkové v IFA , přístupné 9. srpna 2016. (Vyžadován JavaScript)
- ↑ b c d Vstup na fosforu, červená v databázi GESTIS látkové na IFA , přístupné dne 9. srpna 2016. (Vyžadován JavaScript)
- ^ AF Holleman , E. Wiberg , N.Wiberg : Učebnice anorganické chemie . 102. vydání. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , s. 747.
- ↑ a b David R. Lide (Ed.): CRC Handbook of Chemistry and Physics . 90. vydání. (Internetová verze: 2010), CRC Press / Taylor a Francis, Boca Raton, FL, Vlastnosti prvků a anorganických sloučenin, s. 4-142-4-147. Hodnoty tam jsou založeny na g / mol a jsou uvedeny v jednotkách cgs. Zde uvedená hodnota je hodnota SI vypočtená z ní bez měrné jednotky.
- ↑ a b Yiming Zhang, Julian RG Evans, Shoufeng Yang: Opravené hodnoty varných bodů a entalpie odpařování prvků v příručkách. In: Journal of Chemical & Engineering Data. 56, 2011, s. 328-337, doi: 10,1021 / je1011086 .
- ↑ Vstup na červeno / bílého fosforu v seznamu klasifikací a označení všech v Evropské agentury pro chemické látky (ECHA), k dispozici na 14. prosince 2016. Výrobci a distributoři mohou rozšířit do harmonizované klasifikace a označování .
- ↑ Švýcarský fond úrazového pojištění (Suva): Mezní hodnoty-aktuální hodnoty MAK a BAT (hledání 12185-10-3 nebo fosfor bílá / žlutá ), přístup 2. listopadu 2015.
- ^ A b Národní technická informační služba. Vol. AD-B011-150.
- ↑ a b c d Záznam o fosforu v databázi ChemIDplus Národní lékařské knihovny USA (NLM)
- ^ Pesticide Chemicals Official Compendium. Association of the American Pesticide Control Officials, Inc., 1966, s. 901.
- ↑ American Heart Journal . Vol. 84, 1972, s. 139.
- ^ Archiv interního lékařství . Vol. 83, 1949, s. 164.
- ^ Alphons Oppenheim: Brand, Hennig . In: Allgemeine Deutsche Biographie (ADB). Svazek 3, Duncker & Humblot, Lipsko 1876, s. 236.
- ↑ Alexander P. Hardt: Pyrotechnika. Pyrotechnica Publications, Post Falls, Idaho, 2001, ISBN 0-929388-06-2 , s. 74 a násl.
- ^ Mary Weeks, Discovery of the elements, Journal of Chemical Education 1956, s. 135.
- ↑ Schrötter, New Modification of Phosphorus , Liebigs Annalen der Chemie, svazek 68, 1848, s. 247-253
- ↑ Anton Schrötter: O novém alotropickém stavu fosforu . In: JC Poggendorff (Ed.): Annals of Physics and Chemistry, třetí řada . 157 (Pogg. Ann. 81), čís. 10 . Johann Ambrosius Barth, 1850, ISSN 1521-3889 , s. 276–298 , doi : 10.1002 / andp.18501571009 ( online na Gallica Bibliothèque nationale de France ).
- ↑ W. Hittorf, O znalosti fosforu , Annalen der Physik, svazek 202, 1865, s. 193-228
- ↑ Bridgman, Dvě nové modifikace luminoforu , Journal of the American Chemical Society, svazek 36, 1914, s. 1344-1363.
- ^ A b A. F. Holleman , E. Wiberg , N. Wiberg : Učebnice anorganické chemie . 91. - 100., vylepšené a značně rozšířené vydání. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3 , s. 928-931.
- ↑ „Vyčerpání fosforu: Stavitelé bakteriálních kyselin - vládci nad životem a smrtí?“ (Schattenblick, 15. dubna 2008).
- ↑ „ Země dostupné zásoby fosfátu, který je primární složkou hnojiv, by mohly být vyčerpány během příštích 50 až 130 let “, in: A blooming waste, Website University of Technology, Sydney , November 6, 2006; alternativně: „ Vyčerpání současných ekonomicky využitelných zásob se odhaduje někde od 60 do 130 let. S použitím odhadů středních rezerv a za rozumných předpovědí se zdá, že zásoby fosfátu by trvaly nejméně 100+ let “; v Arne Haarr, EUREAU (Evropská unie národních asociací dodavatelů vody a služeb v oblasti odpadních vod): Opětovné použití fosforu .
- ↑ Odpověď spolkové vlády na menší otázku poslanců Cornelie Behmové, Friedricha Ostendorffa, Dorothea Steinera, dalších poslanců a poslaneckého klubu Alliance 90 / The Greens , německý Bundestag, 15. prosince 2012, přístup 27. srpna 2019.
- ↑ Fosfát u USGS Mineral Resources .
- ↑ M. Okrusch, S. Matthes: Mineralogie: Úvod do speciální mineralogie, petrologie a depozitní vědy. 7. vydání. Springer, 2005, ISBN 3-540-23812-3 .
- ↑ Mediální zpráva ze stavebního oddělení kantonu Curych: Přeměna čistírenského kalu na surovinu: Nový postup vhodný pro průmyslovou výrobu. 3. června 2019, přístup 14. října 2019 .
- ↑ Odenwaldův vesmír: Znamená nedostatek fosforu konec lidstva? na: focus.de , 9. května 2008.
- ↑ Dietmar Kunath : Phosophor. In: Claus Schaefer, Torsten Schröer (Hrsg.): Velký lexikon akvaristiky. Eugen Ulmer, Stuttgart 2004, ISBN 3-8001-7497-9 , s. 772.
- ^ A. Matthew et al.: Důkaz pro reaktivní redukované druhy fosforu v raném Archeanském oceánu. In: PNAS. 110 (25), 2013, s. 10089-10094. PMID 23733935 ; pdf (přístup k plnému textu zdarma)
- ↑ Astronomové odhalují mezihvězdnou nit jednoho ze stavebních kamenů života (cs) . In: phys.org . Citováno 28. září 2020.
- ↑ Komety přinesly na Zemi fosfor (stavební kámen života) (de) . 20. ledna 2020. Přístup 28. září 2020.
- ↑ VM Rivilla, MN Drozdovskaya, K. Altwegg, P. Caselli, MT Beltrán, F. Fontani, FFS van der Tak, R. Cesaroni, A. Vasyunin, M. Rubin, F. Lique, S. Marinakis, L. Testi , tým ROSINA: ALMA a ROSINA detekce molekul nesoucích fosfor: mezihvězdné vlákno mezi hvězdotvornými oblastmi a kometami . In: Měsíční oznámení Královské astronomické společnosti . 11. února 2020, s. 1180–1198. arxiv : 1911.11647 . doi : 10,1093 / mnras / stz3336 .
- ↑ Vstup na fosfor. In: Römpp Online . Georg Thieme Verlag, přístup 13. ledna 2015.
- ^ Soda Springs. ( Memento z 24. července 2016 v internetovém archivu ) na: monsanto.com
- ↑ Stránka federálních smluv ukazuje, že se USA spoléhají na dodávky bílého fosforu ze strany Monsanta a izraelské firmy , 7. února 2013.
- ↑ Horst Briehl: Chemie materiálů . Springer-Verlag, 2014, ISBN 978-3-658-06225-5 , s. 24 ( omezený náhled ve vyhledávání knih Google).
- ↑ Ralf Steudel : Chemie nekovů od struktury a vazby k aplikaci . Walter de Gruyter, 2008, ISBN 978-3-11-021128-3 , s. 360 ( omezený náhled v Google Book Search).
- ↑ Brandi M. Cossairt, Christopher C. Cummins, Ashley R. Head, Dennis L. Lichtenberger, Raphael JF Berger, SA Hayes, NW Mitzel, G. Wu,: O molekulárních a elektronických strukturách AsP 3 a P 4 . In: Journal of the American Chemical Society . páska 132 , č. 24 , 23. června 2010, ISSN 0002-7863 , s. 8459-8465 , doi : 10,1021 / ja102580d ( acs.org [přístup 3. července 2020]).
- ↑ Alfons Klemenc: Anorganická chemie na fyzikálně-chemickém základě . Springer-Verlag, 2013, ISBN 978-3-7091-7793-8 , s. 202 ( omezený náhled ve vyhledávání knih Google).
- ↑ Stefanie Ortanderl, Ulf Ritgen: Chemistry for Dummies. Učebnice . John Wiley & Sons, 2014, ISBN 978-3-527-70924-3 , str. 541 ( omezený náhled ve vyhledávání knih Google).
- ^ Dietrich Wertz: Luminiscence . diplom.de, 2004, ISBN 3-8324-8284-9 , s. 29 ( omezený náhled ve vyhledávání knih Google).
- ↑ retro; bryndáček - Stránka z manuálu drogistické praxe : prostředky proti škůdcům.
- ↑ J. Sedlmeyer: O otravě fosforem. In: Německý časopis pro veškeré soudní lékařství. Svazek 19, č. 1, prosinec 1932, s. 365-383; ( doi: 10,1007 / BF01750213 ).
- ↑ Leták k BK č. 1109: Nemoci způsobené fosforem nebo jeho anorganickými sloučeninami , oznámení BMA z 25. února 1981, BArbBl Heft 4/1981.
- ↑ Jak funguje roztok síranu měďnatého při detoxikaci bílého fosforu. na: www.chemieunterricht.de .
- ↑ Stefan Lange, Peer Schmidt, Tom Nilges: Au 3 SnP 7 @Black Phosphorus: Snadný přístup k černému fosforu. In: Inorg. Chem. 46 (10), 2007, str. 4028-4035; doi: 10,1021 / ic062192q .
- ↑ G. Brauer (Ed.): Handbook of Preparative Anorganic Chemistry. 2. vydání. Vol.1, Academic Press 1963, s. 518-525.
- ↑ Základy a hlavní prvky skupiny Volume 1: Basics and main group elements . Walter de Gruyter GmbH & Co KG, 2016, ISBN 3-11-049585-6 , s. 852 ( omezený náhled ve vyhledávání knih Google).
- ↑ H. Thurn, H. Krebs: O struktuře a vlastnostech polokovů. XXII. Krystalová struktura Hittorfova fosforu. In: Acta Cryst. B25, 1969, s. 125-135.
- ↑ H. Thurn: Krystalová struktura Hittorfova fosforu. Disertační práce . Technická univerzita ve Stuttgartu, 1967.
- ↑ Arno Pfitzner, Michael F. Bräu, Josef Zweck, Gunther Brunklaus, Hellmut Eckert: Phosphorus Nanorods - dvě alotropické úpravy dlouho známého prvku. In: Angew. Chem. Ed. 43, 2004, s. 4228-4231; doi: 10.1002 / anie.200460244 .
- ↑ E.-C. Koch: Speciální materiály v pyrotechnice: IV. Chemie fosforu a jeho sloučeniny. In: J. Pyrotech. 21, 2005, s. 39; Abstrakt .
- ↑ E.-C. Koch: Speciální materiály v pyrotechnice: V. Vojenské aplikace fosforu a jeho sloučenin. In: Propellants Explos. Pyrotechnika. 33, 2008, s. 165; doi: 10.1002 / prep.200700212 .
- ↑ Dietmar Kunath: Fosfor. In: Claus Schaefer, Torsten Schröer (Hrsg.): Velký lexikon akvaristiky. 2 svazky. Eugen Ulmer, Stuttgart 2004, ISBN 3-8001-7497-9 , 772.
- ↑ Emanuel Epstein: Anomálie křemíku v biologii rostlin. In: Proč. Natl. Akadem. Sci. USA 91, 1994, s. 11; doi: 10,1073 / pnas.91.1.11 .
- ↑ Lincoln Taiz, Eduardo Zeiger: Fyziologie rostlin. Spectrum, Akad. Verlag, Heidelberg / Berlin 1998, ISBN 3-8274-0537-8 .
- ↑ K. Mengel: Výživa a metabolismus rostliny. Gustav Fischer Verlag, Jena 1991, s. 324–334.
- ↑ Zbytky munice : Granáty v Baltském moři. ( Memento ze 14. března 2008 v internetovém archivu ) na: sueddeutsche.de , 9. ledna 2008.
- ↑ Zbytky munice v Baltském moři. "Úřady neprojevují žádný zájem". dne: sueddeutsche.de , 8. ledna 2008.
- ↑ Stefan Nehring: Nehody s municí - a žádný konec. dne: travemuende-aktuell.de , 2015.
- ↑ DGUV.de: BGR / GUV-SR 2003 Výuka ve školách s nebezpečnými látkami (online verze; soubor PDF; 9,52 MB), s. 24, přístup 25. dubna 2011.
- ^ A b Nils Wiberg, Egon Wiberg, Arnold Frederik Hollemann: Inorganische Chemie . Volume 1: Basics and main group elements. 103. vydání. De Gruyter, Berlin, Boston 2017, ISBN 978-3-11-051854-2 , pp. 783 ff . (přístup přes De Gruyter Online)























![{\ displaystyle {\ ce {PO4 ^ 3- + 12MoO4 ^ 2- + 24H3O + + 3NH4 + <=> (NH4) 3 [P (Mo3O10) 4] + 36 H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb26219c3cab9f7c0612f33ef53af1422e1214ff)


![{\ Displaystyle {\ ce {H2PO4- + 12 [MoO2Cl3 (H2O)] + 26 H2O-> [P (Mo3O10) 4] ^ 3- + 26 H3O + + 36Cl-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6363079e9a055be6d511005c74fb931ca9f8abd5)
![{\ Displaystyle {\ ce {[P (Mo3O10) 4] ^ 3- + 3HOx + 3H3O + -> (H2Ox) 3 [P (Mo3O10) 4] + 3H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3f23c5ca64a72c9d6438fce291f757851636270c)
![\ mathrm {(H_2Ox) _3 [P (Mo_3O_ {10}) _ 4] \ cdot x \ H_2O}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b4a4ac6f7c69607fc6cb08462cc8acb0da733f77)
![\ mathrm {(H_2Ox) _3 [P (Mo_3O_ {10}) _ 4]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4015e1b4d1a83dc0b2c857e26fa6cdef99a7a9da)