draslík
| vlastnosti | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Obvykle | |||||||||||||||||||||||||||||||||||||||||||||||||
| Jméno , symbol , atomové číslo | Draslík, K, 19 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Kategorie prvků | Alkalické kovy | ||||||||||||||||||||||||||||||||||||||||||||||||
| Skupina , tečka , blok | 1 , 4 , s | ||||||||||||||||||||||||||||||||||||||||||||||||
| Vzhled | stříbřitě bílá | ||||||||||||||||||||||||||||||||||||||||||||||||
| Číslo CAS | |||||||||||||||||||||||||||||||||||||||||||||||||
| Číslo ES | 231-119-8 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Informační karta ECHA | 100,028,290 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Hmotnostní zlomek zemského obalu | 2,41% | ||||||||||||||||||||||||||||||||||||||||||||||||
| Atomový | |||||||||||||||||||||||||||||||||||||||||||||||||
| Atomová hmotnost | 39.0983 (1) a kol | ||||||||||||||||||||||||||||||||||||||||||||||||
| Atomový poloměr (vypočteno) | 220 (243) hodin | ||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentní poloměr | 203 hod | ||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsův poloměr | 275 hod | ||||||||||||||||||||||||||||||||||||||||||||||||
| Konfigurace elektronů | [ Ar ] 4 s 1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionizační energie | 4. místo.340 663 69 (9) eV ≈ 418.81 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionizační energie | 31.62500 (19) eV ≈ 3 051.35 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionizační energie | 45.8031 (17) eV ≈ 4 419.3 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionizační energie | 60.917 (19) eV ≈ 5 878 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionizační energie | 82.66 (16) eV ≈ 7 975 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| Fyzicky | |||||||||||||||||||||||||||||||||||||||||||||||||
| Fyzický stav | pevný | ||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalická struktura | krychlový na tělo | ||||||||||||||||||||||||||||||||||||||||||||||||
| hustota | 0,856 g / cm 3 (20 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Mohsova tvrdost | 0,4 | ||||||||||||||||||||||||||||||||||||||||||||||||
| magnetismus | paramagnetický ( Χ m = 5,7 10 −6 ) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Bod tání | 336,53 K (63,38 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| bod varu | 1047 K (774 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Molární objem | 45,94 · 10 −6 m 3 · mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Teplo odpařování | 79,1 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| Teplo fúze | 2,334 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Rychlost zvuku | 2000 m s −1 při 293,15 K. | ||||||||||||||||||||||||||||||||||||||||||||||||
| Specifická tepelná kapacita | 757,8 J kg −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pracovní funkce | 2,30 eV | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrická vodivost | 14,3 · 10 6 A · V −1 · m −1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Tepelná vodivost | 100 W m −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Chemicky | |||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidační stavy | -1, +1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Normální potenciál | −2,931 V (K + + e - → K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativita | 0,82 ( Paulingova stupnice ) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopy | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Další izotopy najdete v seznamu izotopů | |||||||||||||||||||||||||||||||||||||||||||||||||
| Vlastnosti NMR | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| bezpečnostní instrukce | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
|
Pokud je to možné a obvyklé, používají se jednotky SI . Pokud není uvedeno jinak, uvedené údaje platí pro standardní podmínky . | |||||||||||||||||||||||||||||||||||||||||||||||||
Draslík ( latinsky , z arabštiny القلية( DMG al-qalya „rostlinný popel“) je chemický prvek se symbolem prvku K (dříve také Ka) a atomovým číslem 19. V periodické tabulce je v první hlavní skupině nebo 1. skupině IUPAC a je jedním z jsou alkalické kovy .
Draslík je jedním z deseti nejvíce společných prvků v této zemského pláště a vyskytuje se v mnoha minerálních látek v zemské kůře .
příběh


Dne 19. listopadu 1807, Humphry Davy hlášeno na Royal Society v Londýně, že se mu podařilo získat dva různé kovy tím, elektrolýzou slabě zvlhčený žíravé louhy; Jeden z kovů, poprvé extrahovaný 6. října 1807, nazval draslík (anglický a francouzský výraz pro draslík, který se používá dodnes), protože jej lze extrahovat z potaše , zatímco druhým, získaným o několik dní později, je sodík (který se používá dodnes anglicky a francouzský název sodné soli ), protože je obsažen v různých modifikacích na uhličitanu sodného (soda). V německy mluvícím světě je Sodium Davys od roku 1811 označován jako sodík , podle návrhu Berzelius , zatímco pro Kalium Davys se používá termín Kalium (z arabštiny), zavedený Klaprothem v roce 1796.القَلْيَة al-qalya = popel, získatelný z rostlinného popela) převzal.
Výskyt
Draslík se přirozeně vyskytuje pouze jako kation ve sloučeninách draslíku. To je způsobeno skutečností, že má pouze jeden vnější elektron a že je velmi ochotný se ho vzdát, aby získal stabilní a nízkoenergetický vnější elektronový obal . Kovalentní sloučeniny draslíku proto nejsou známy. Průměrná koncentrace v mořské vodě je 399,1 mg K + / kg = 408,4 mg K + / l.
Přirozeně se vyskytující minerály obsahující draslík jsou:
- Sylvin - KCl
- Sylvinit - KCl · NaCl
- Karnallit - KCl · MgCl 2 · 6H 2 O
- Kainit - KCl · MgSO 4 · 3H 2 O
- Schönite - K 2 SO 4 • MgSO 4 • 6 H 2 O
- Polyhalit - K 2 SO 4 · MgSO 4 · MgSO 4 · 2 CaSO 4
- Ortokláza (draselný živec) - K [AlSi 3 O 8 ]
- Moskvit ( potašová slída ) - KAl 2 (OH, F) 2 [AlSi 3 O 10 ]
Draselné soli vytvářejí na bývalých mořských dně odpařovací usazeniny , což činí extrakci draselných solí v těchto oblastech ekonomickou. Potašová sůl se těží v Kanadě, Rusku, Bělorusku, Kazachstánu, Německu, Izraeli, USA, Jordánsku a dalších lokalitách po celém světě. Největší naleziště, která byla kdy nalezena, jsou 1 000 metrů pod povrchem v kanadské provincii Saskatchewan. Tyto usazeniny se nachází v Elk Point Group, který tvořil v centrální devonu . V Saskatchewanu , kde od 60. let 20. století fungovalo několik velkých dolů, byla zavedena technika zmrazování mokrého písku (formace Blairmore), která jimi proháněla důlní šachty . Hlavní těžební společností v Saskatchewanu je společnost Potash Corporation . Izrael a Jordánsko používají jako zdroj potaše vodu z Mrtvého moře , zatímco koncentrace v normálních oceánech je pro komerční produkci za současné ceny příliš nízká.
V roce 2010 byl v atmosféře exoplanet XO-2b a HD 80606 b detekován draslík .
Extrakce a prezentace
Kovový draslík lze extrahovat několika způsoby. Byly použity elektrolytické procesy, jako je proces Degussa nebo tepelný proces od závodu IG Farben , Griesheim. Většina z draslíku, avšak s tím, že v roce 1950 Mine Safety Appliances vyrobené zavedena metoda MSA, v nichž při 870 ° C pod atmosférou ochranného plynu s kovovým sodíkem je snížení z chloridu draselného se provádí. Výsledný plynný draslík se kondenzací kondenzuje ve studené pasti .
Komerčně dostupné slitiny Na-K jsou také přístupné změnou destilačních parametrů.
Elementární draslík lze v laboratoři nalézt redukcí chromátu nebo dichromanu pomocí zirkonia podle:
nebo tepelný rozklad azidu draselného :
stejně jako následná destilace ve vysokém vakuu jsou k dispozici.
vlastnosti
Analogicky k ostatním alkalickým kovům draslík často velmi prudce reaguje s mnoha dalšími prvky a sloučeninami , zejména s nekovy , a vyskytuje se pouze chemicky vázaný v přírodním prostředí . Draslík má vyšší reaktivitu než sodík a prudce reaguje s vodou za vzniku hydroxidu draselného a uvolňování vodíku . Vysokorychlostní záznamy reakce alkalických kovů s vodou naznačují Coulombovu explozi .
- Reakce draslíku s vodou
V důsledku silně exotermické reakce se vodík vznítí, když do něj vstupuje vzduch. To může vést k deflagraci a výbuchům . V suchém kyslíku kov hoří intenzivním fialovým plamenem za vzniku hyperoxidu draselného KO 2 a peroxidu draselného K 2 O 2 .
- resp.
- Reakce draslíku s kyslíkem
Ve vlhkém vzduchu reaguje velmi rychle s vodou a oxidem uhličitým za vzniku uhličitanu draselného za tvorby vodíku .
- Reakce draslíku s vodou a oxidem uhličitým
Draslík reaguje s alkoholy za vzniku alkoholátů za vzniku vodíku .
- Reakce draslíku s ethanolem
Stejně jako všechny alkalické kovy je draslík snadno rozpustný v kapalném amoniaku a vytváří modrofialový roztok . S halogeny bromem a jodem v kapalné nebo pevné formě se draslík výbušně převede na odpovídající halogenidy .
Pro likvidaci draslíku, se obvykle doporučuje se opatrně vpraví malé kousky kovu do velkého přebytku terc-butyl- alkohol , se kterou reaguje tvorby alkoholátu a vodík . Protože tato reakce probíhá velmi pomalu, může se stát, že malé zbytky draslíku zůstanou bez povšimnutí, pokryté krustou terc- butanolátu draselného . Proto je třeba věnovat úplnou reakci pečlivou pozornost . Alternativně lze pro malá množství draslíku použít také 1-butanol , který reaguje s draslíkem rychleji, ale je stále kontrolovatelný. Za žádných okolností by se neměly používat „nižší“ alkoholy ( propanoly , ethanol nebo methanol ), protože tyto reagují příliš prudce s draslíkem a jsou také hořlavější .
Ve vzduchu , lesklý stříbřitě bílý řez povrch čerstvého kovu je pokryta namodralá třpytivou vrstvou oxidu a hydroxidu a malým množstvím uhličitanu během několika vteřin . Ponechán stát ve vzduchu, stejně jako všechny alkalické kovy, pomalu a úplně reaguje za vzniku uhličitanu . Kovový draslík se proto používá v bezvodých organických kapalinách , jako je např. B. skladovaný parafinový olej. Na rozdíl od sodíku může draslík po delším skladování stále tvořit krusty oxidů , peroxidů a hydroxidů , které obalují kov ve formě načervenalých vrstev a které mohou při dotyku nebo lisování explodovat . Bezpečná likvidace pak již není možná; jedinou možností je spálit celý kontejner za kontrolovaných podmínek. Draslík svařovaný do polyethenových obalů může být také potažen výbušnou kůrou, takže takové obaly nejsou vhodné pro skladování .
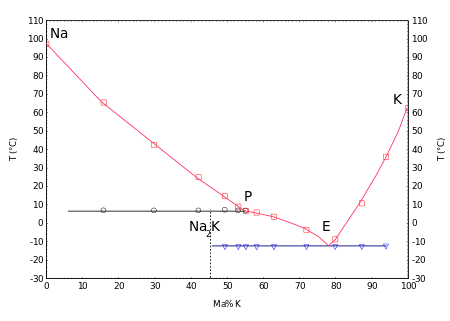
Kapalné směsi se tvoří se sodíkem v širokém rozmezí koncentrací při pokojové teplotě , viz: NaK (slitina) . Na fázový diagram znázorňuje neslučitelná tání sloučeniny Na 2 K při teplotě 7 ° C a eutektické při -12,6 ° C, s obsahem sodíku v 23% w .
použití
Draslík byl použit jako chladicí kapalina v některých vysokorychlostních jaderných reaktorech ve formě eutektické slitiny Na-K . Jinak má kovový draslík malý technický význam, protože může být nahrazen levnějším sodíkem .
Ve výzkumné laboratoři draslíku je příležitostně pro sušení z rozpouštědel použitých, zvláště, když je teplota varu rozpouštědla nad teplotou tání draslíku, ale nižší než je teplota tání sodíku se nachází. Poté se draslík roztaví ve vroucím rozpouštědle a jeho povrch se nezakryje. Potřebujete tedy podstatně méně alkalického kovu a ten lze téměř úplně spotřebovat v procesu sušení, takže je třeba zlikvidovat jen velmi malé zbytky.
Když draslík necháte delší dobu stát, vytvoří krusty peroxosloučenin (K 2 O 2 a KO 2 ), a to i pod ochrannou kapalinou ( ropou ), které reagují velmi výbušně . I při nízkém tlaku , zejména při zvedání kousků draslíku kleštěmi nebo při pokusu o řezání nožem , mohou tyto peroxidové sloučeniny vyvolat výbuchy . Jako protiopatření se doporučuje buď roztavení ve skleněných ampulkách, nebo skladování pod ochrannou kapalinou a inertním plynem . Kromě toho kvůli riziku výbuchu nesmějí být halogenovaná rozpouštědla sušena draslíkem. Reakce draslíku ve souhře rozpouštědel, které mohou snadno uvolňovat kyslík , jsou také nebezpečné .
Další použití:
- Doping wolframových drátů pro výrobu vláken žárovek
- Tepelná slitina Na-K (viz sodík )
- Ve formě draselné hyperoxidem KO 2 jako vzduch draselného filtru (viz draselných kazet ), mimo jiné, při použití na ponorkách k dýchání vzduchu regenerace
Biologický význam
Význam jako hnojivo
Ve vodě rozpustné draselné soli se používají jako hnojiva, protože rostliny mají potíže s trávením křemičitanů draselných nacházejících se v půdě .
Průmyslové zemědělství využívá hnojiva k do sklizně nahradit ztracené draslíku. Většina zemědělských hnojiv obsahuje chlorid draselný , zatímco síran draselný se používá pro plodiny citlivé na chloridy nebo plodiny s vyšším obsahem síry . Jen málo hnojiv obsahuje dusičnan draselný . Dalšími hnojivy obsahujícími draslík jsou Kornkali s oxidem hořečnatým , Patentkali, Flory, Nitrophoska a fosforečnan draselný .
Esenciální makronutrient draslík má v rostlinách široké spektrum účinků . V xylému slouží jako osmotikum , které je klíčové pro vytváření kořenového tlaku. Draslík v buňkách listu zvyšuje turgor , což vede k prodloužení buněk a růstu povrchu listu. Zvýšením turgoru také zajišťuje otevření průduchů , což podporuje příjem oxidu uhličitého, a má tedy přímý vliv na fotosyntézu . Pokud je draslík k dispozici v dostatečném množství, podporuje v prvním kroku tvorbu cukrů C3 , které se v dalších metabolických procesech ovlivněných draslíkem zpracovávají na škrob , celulózu , lignin a bílkoviny . Rostliny, které trpí nedostatkem draslíku, vykazují příznaky hlavně na starších listech . Draslík je z nich retranslokován a přes floém transportován do mladých listů. Typickými příznaky nedostatku draslíku jsou bodová, interkostální a chloróza na okraji listu a nekróza na okraji listu . Existuje také stlačený habitus a možná i vadnutí . Silné sluneční světlo může způsobit fotooxidaci v listech. Větší nadbytek způsobuje popáleniny kořenů a nedostatek vápníku nebo hořčíku .
Draslík je antagonistou vápníku - oba výživové prvky proto musí být v rostlině i v půdě přítomny ve správném poměru .
Význam pro lidské tělo
Draslík je základní minerál ( objemový prvek ) pro udržení života . Jako nejdůležitější intracelulární kation se draslík podílí na fyziologických procesech v každé buňce:
- Bioelectricity z buněčných membrán , d. H. normální nervosvalová dráždivost, stimulace a vedení srdce
- Regulace buněčného růstu
- Vliv ochranných (ochranných) endotelových cévních funkcí
- Udržování normálního krevního tlaku
- Regulace acidobazické rovnováhy ovlivněním vylučování kyseliny ledvinovou
- Ovlivňuje uvolňování hormonů (např. Inzulínu z beta buněk )
- Využití sacharidů a syntéza bílkovin
Doporučené a skutečné příjmy draslíku
Aby byly zachovány všechny životně důležité fyziologické procesy, doporučuje se konzumovat alespoň 2 g draslíku denně. Potravin a výživy Board (FNB) v USA a Kanadě se však považuje za příjem 4,7 g / den (120 mmol / den), aby bylo vhodné pro všechny dospělé od preventivního hlediska. Na základě nových zjištění je toto množství draslíku (z potravy) nezbytné k prevenci, snížení nebo oddálení chronických onemocnění, jako je zvýšený krevní tlak , citlivost na sůl , ledvinové kameny , úbytek kostní hmoty nebo mozkové mrtvice .
Podle National Nutrition Survey II (NVS II) je příjem draslíku v Německu v mediánu 3,1 g / den (ženy) nebo 3,6 g / den (muži). Příjem 4,7 g draslíku denně doporučený FNB nedosahuje 75% mužů a 90% žen.
Význam poměru sodík / draslík

Draslík hraje důležitou roli při regulaci membránového potenciálu v těle . Nitrobuněčná koncentrace draslíku se pohybuje kolem 150 mmol / l, extracelulárně je to 4 mmol / l. Nitrobuněčná koncentrace sodíku se pohybuje kolem 10 mmol / l, extracelulární kolem 140 mmol / l. Tyto rozdíly v koncentracích jsou udržovány Na / K-ATPázou a jsou životně důležité pro funkci buňky. Trvalý posun těchto buněčných koncentrací může vést k srdeční zástavě systoly se zvýšenou koncentrací K + ( hyperkalemie ), tj. K + >> 4,5 mmol / l, a k hypokalémii (K + <3,5 mmol / l) Snížení schopnosti svaly ke stažení, zvýšené vzrušení, narušení vedení vzruchu, extrasystoly srdce. K + je (kromě Na + ) rozhodující pro osmotický tlak buněk, tj. Pro obsah vody v buňce. Příliš nízká koncentrace K + v krvi vede k srdeční zástavě v diastole . Normální rozmezí v séru je 3,6–4,5 mmol / l, v moči je 26–123 mmol / l. To znamená, že se neustále ztrácí K + , které je třeba nahradit jídlem.
To je v dnešní době obzvláště problém, protože západní strava je charakterizována konzumací živočišných potravin. Příjem rostlinných potravin bohatých na draslík je však ve srovnání s dřív výrazně snížen. Před rozvojem zemědělství byl příjem draslíku 10,5 g / den, ve srovnání s průměrem 3,4 g / den podle NVS II. Na druhé straně byl příjem sodíku, který byl posunut do opačného směru, dříve pouze 0,8 g / den a díky naší dietě s vysokým obsahem soli se zvýšil na průměrně 3,1 g / den (ženy) a 4,3 g / den (muži). To ovlivňuje přirozený poměr draslíku a sodíku v lidském těle.
Draslík je přirozeným antagonistou sodíku a vyvážený poměr těchto dvou minerálů je zvláště důležitý pro regulaci fyziologických procesů. Nadměrný příjem sodíku může vést k vyčerpání draslíku. Naopak, draslík má natriuretický účinek. V tomto ohledu je poměr Na / K v potravině rozhodující než koncentrace jednotlivých kationtů samotných. WHO doporučuje molární poměr obou minerálů 1: 1. Tomuto poměru odpovídá doporučení WHO pro méně než 2 g sodíku denně a nejméně 3,5 g draslíku denně.
Fyziologický význam
Kromě sodíku má pro regulaci krevního tlaku velký význam draslík . Epidemiologické studie ukazují, že zvýšený příjem draslíku je spojen se snížením krevního tlaku a snižuje riziko mrtvice. Antihypertenzní účinek draslíku byl také prokázán při pokusech o doplnění .
Krevní tlak by mohla snížit také takzvaná dieta DASH (dietní přístupy k zastavení hypertenze) (bohatá na celozrnné cereální produkty, ovoce, zeleninu, drůbež, ryby a ořechy). Na rozdíl od obvyklé stravy obsahuje tato dieta méně kuchyňské soli a nasycených tuků, relativně velké množství draslíku, ale také více dalších živin, jako je hořčík a vápník, které jsou také zodpovědné za snižování krevního tlaku. Z tohoto důvodu by měla být doporučena strava bohatá na ovoce a zeleninu (bohatá na draslík) v kombinaci s mírným omezením příjmu sodíku, protože poměr sodíku k draslíku 1 nebo méně má příznivý vliv na krevní tlak. Upravit příjem draslíku na vysoký příjem sodíku nedává smysl. Evropský úřad pro bezpečnost úřad (EFSA) rovněž potvrzuje krevní tlak zvyšující účinek sodíku.
Draslík má také pozitivní vliv na kostní metabolismus, protože vyšší příjem draslíku brání zvýšenému vylučování vápníku, což je způsobeno vysokým příjmem soli. Draslík tak podporuje retenci vápníku v ledvinách a brání odbourávání vápníku z kostí . V této souvislosti je třeba vzít v úvahu také vliv doprovodného aniontu, složení potravin a stáří na acido-bazický stav. Klinické studie ukázaly, že citrát draselný působí proti ztrátě vápníku ledvinami a odbourávání vápníku z kostí. Prospektivní kontrolovaná intervenční studie u 161 postmenopauzálních žen s osteopenií ukázala, že částečná neutralizace expozice kyselinou vyvolané dietou (s použitím 30 mmol citrátu draselného denně, což odpovídá 1,173 g draslíku) po dobu dvanácti měsíců výrazně zvyšuje hustotu kostí a výrazně zlepšuje kost struktura. Citrát draselný byl stejně účinný jako raloxifen , modulátor estrogenových receptorů používaný při léčbě a prevenci osteoporózy u postmenopauzálních žen.
Draslík je důležitý elektrolyt . Ionty draslíku se nacházejí hlavně uvnitř buňky ( intracelulárního prostoru ), kde se podílejí na udržování klidového potenciálu . Proto mohou vysoké ztráty draslíku, například silným pocením , vést ke křečím a stavům vyčerpání.
Potraviny bohaté na draslík mají diuretický / dehydratační účinek . U pacientů na dialýze -pflichtigen s poruchou funkce ledvin je důležité, aby se vyhnuli silným potravinám obsahujícím draslík, protože to může způsobit životně nebezpečnou hyperkalémii.
Smrtelná injekce používaná při popravách ve Spojených státech obsahuje mimo jiné chlorid draselný , který paralyzuje srdeční svaly a vede tak k úmrtí.
Další informace o fyzických účincích draslíku
Hladiny draslíku v potravinách
Mezi potraviny bohaté na draslík patří houby, banány, datle, rozinky, fazole, chilli, sýr, špenát a brambory, které obsahují 0,2 až 1,0 g draslíku na 100 g potraviny.
Hladiny draslíku v potravinách bohatých na draslík v mg na 100 g; z národní databáze živin USDA (2011)
| Jídlo 100 g | draslík |
|---|---|
| Sója (sušená) | 1 800 mg |
| Meruňky (sušené) | 1370 mg |
| Pšeničné otruby | 1350 mg |
| pistácie | 1020 mg |
| Rajčatová pasta | 1 014 mg |
| Červená řepa -listy (vařené) | 909 mg |
| čočky | 840 mg |
| Rozinky | 749 mg |
| Mandle | 705 mg |
| Koncentrát pomerančového džusu | 674 mg |
| arašíd | 658 mg |
| Datum (Deglet Nour) | 656 mg |
| sójové mléko | 638 mg |
| Sladké kaštany (pražené) | 592 mg |
| Pohanková mouka (celozrnná) | 577 mg |
| Kešu | 565 mg |
| Hranolky (rostlinný olej) | 550 mg |
| Brambory (neloupané, pečené) | 535 mg |
| Sója (vařená) | 515 mg |
| avokádo | 485 mg |
| Grapefruitová šťáva (bílá) | 484 mg |
| Špenát (vařený) | 466 mg |
| Jitrocele (vařené) | 464 mg |
| bílé fazole | 454 mg |
| Rajčatové pyré | 439 mg |
| Fazole (vařené) | 402 mg |
Jelikož jsou draselné soli obsažené v potravinách velmi rozpustné ve vodě, lze obsah draslíku v potravinách znatelně snížit takzvaným namáčením ( máčení ve vodě asi tři až pět hodin). To je zvláště důležité pro lidi s poruchami ledvin a metabolismu.
radioaktivita
Přírodní draslík se skládá z 0,0117 procenta radioaktivního izotopu 40 K, a proto má specifickou aktivitu 31,6 Becquerelu na gram. S 0,17 mSv za rok, téměř 10 procent dávky přirozeného záření v Německu (v průměru 2,1 mSv za rok) zpět tělu vlastní draslík.
40 K rozkládá přes beta-rozpadu : s pravděpodobností 89% přes beta - -decomposition do stabilní 40 vápníku a s 11% pravděpodobností přes β + -decay nebo elektronového záchytu (ES, K-zachycení) na stabilní 40 argonu . Poločas rozpadu je 1,248 miliardy let.
Rozpad z 40 K na 40 Ar je základním zdrojem argonu v zemské atmosféře a lze jej také použít ke stanovení stáří pomocí draslíkovo-argonového datování .
Fyzická zvláštnost
Kov draslíku se může podle počítačové simulace za extrémního tlaku současně pevné a kapalné být, protože v závislosti na simulaci pak i když většina z atomů v tuhých tyčí , ale uspořádat několik atomů pro kapaliny , aby se. Při extrémním tlaku je draslík pevným blokem, ze kterého současně uniká tekutý draslík.
Důkaz draslíku

Kromě spektroskopické detekce na základě barvy plamene mohou být ionty draslíku rozpuštěné ve vodě detekovány a stanoveny potenciometricky pomocí iontově selektivní elektrody specializující se na K + . Většina draslíkových elektrod využívá specifickou komplexaci draslíku valinomycinem C 54 H 90 N 6 O 18 , který je zapuštěn do plastové membrány v koncentraci kolem 0,7%.
Kvalitativní důkaz draslíku je možné pomocí kyseliny chloristé . Chloristan draselný (KClO 4 ) , který je v chladu ve vodě málo rozpustný , se tvoří jako bílá sraženina . Vysráží se však jiné kationty formy, jako je rubidium , cesium a amonné běloby, těžké v chladu rozpustných .
Draslík lze kvantitativně stanovit pomocí gravimetrie . Zde je draslík jako tetraphenylboritan draselný (K [B (C 6 H 5 ) 4 ]) přidáním do roztoku s vysrážením Kalignost a výsledná sraženina je vyvážena.
Další důkazy, je možné, protože srážky z hexanitrocobaltate draselného (III) , vinanu draselného (K A = 3,80 x 10 -4 ) a hexachloroplatinate draselného (IV) .
V rutinní analýzy ( klinická chemie ( krev ), chemie životního prostředí , chemie vody ), draselný se určuje kvantitativně až na úroveň trasování s použitím plamenovou fotometrií . Zde uvedený limit kvantifikace je 100 µg / l. V atomové absorpční spektrometrii je stále možné detekovat 1 µg / l plamenovou technikou a 0,004 µg / l technikou grafitové pece.
Odkazy
→ Kategorie: Sloučenina draslíku
Ve svých sloučeninách se draslík vyskytuje pouze jako monovalentní kation v oxidačním stavu 1.
Oxidy
Oxid draselný je velmi reaktivní bílá pevná látka a má antifluoritovou krystalovou strukturu v systému krychlových krystalů v prostorové skupině Fm 3 m (vesmírná skupina č. 225) . Tam jsou polohy aniontů a kationtů obráceny vzhledem k jejich pozicím ve fluoritu , přičemž ionty draslíku jsou vázány na 4 ionty oxidu a ionty oxidu vázané na 8 iontů draslíku.
Peroxid draselný je velmi reaktivní oxidující pevná látka, která není sama o sobě hořlavá , ale prudce reaguje s hořlavými látkami . Při kontaktu s vodou se prudce rozkládá . Používá se jako okysličovadlo a bělidlo a také k čištění vzduchu .
Hyperoxid draselný je žlutá, slaná sloučenina . Ve vodě se rozkládá za vzniku hydroxidu draselného , peroxidu vodíku a kyslíku .
Halogenidy
Chlorid draselný tvoří bezbarvé, ve vodě snadno rozpustné krystaly bez zápachu . Chlorid draselný se přirozeně vyskytuje jako sylvine . Dalšími běžnými minerály a horninami obsahujícími draslík a chlorid jsou karnallit (KCl · MgCl 2 · 6 H 2 O), kainit (KCl · MgSO 4 · 3 H 2 O) a sylvinit (KCl · NaCl). Používá se v potravinářském průmyslu jako zpevňující činidlo a zvýrazňovač chuti . Používá se k výrobě z potaše hnojiva a téměř všechny sloučeniny draslíku používané průmyslově, jako je uhličitan draselný , hydroxid draselný použitý.
Fluorid draselný je bílý, hygroskopický prášek, který se obvykle vyskytuje jako dihydrát . To se používá pro výrobu z glazury , jako cementové přísady , jako oxidové složky rozpouštět hliníkových svařování prášků, jako ochranu dřeva a pro leptání skla .
Bromid draselný se používá pro výrobu z stříbra - emulzí na filmy a desky pro fotografické filmy používané. Ve fotografických vývojářích působí proti zamlžování a zpožďuje vývoj.
Jodid draselný je v laboratoři pro přípravu použitého roztoku jodid-jodid draselný (Lugolův roztok). Používá se také při výrobě jodidu stříbrného a při výrobě z léčiv a v analytické chemii pro detekci některých sloučenin .
Všechny tyto sloučeniny draslíku mít kubickou krystalovou strukturu na chloridu sodného typu.
Více spojení
Hydroxid draselný je bílá, hygroskopická pevná látka bez zápachu. Ve vodě se rozpouští za vzniku silné báze hydroxidu draselného a vytváří velké množství tepla . V mikrosystémové technologii se používá pro selektivní anizotropní leptání monokrystalického křemíku . V mikrobiologii se používá k rozlišení grampozitivních a gramnegativních bakterií v postupu rychlého testu. Používá se jako elektrolyt v galvanických kyslíkových senzorech. Stejný účel plní v rozšířených alkalicko-manganových článcích a historicky důležitých nikl-kadmiových bateriích . Používá se jako regulátor kyselosti v potravinářském průmyslu.
Uhličitan draselný je bílý, hygroskopický prášek. Má monoklinickou krystalovou strukturu v prostorové skupině P 2 1 / c (vesmírná skupina č. 14) . Používá se při výrobě ze skla , laku a fotografické vývojky .
Hydrogenuhličitan draselný se používá jako uvolňovací činidlo a regulátor kyselosti v potravinách a jako kypřící činidlo .
Chlorečnan draselný je bílá stabilní sůl, která ve vodě vytváří bezbarvý roztok . Spojení má silné oxidační a vůli mimo jiné pro výrobu všech zápasů , třaskavých čepic a dalších pyrotechnických výrobků používaných.
Chloristan draselný ve své čisté formě tvoří kosočtvercové hranoly, které mohou mít velikost až několik centimetrů. Krystalová soustava je kosočtverečné v prostorové grupy Pnma (prostorové skupině č. 62) . Často se používá v pyrotechnice kvůli silnému účinku podporujícímu oheň a dobré skladovatelnosti , například jako oxidační činidlo v blescích . V raketových motorech se používá jen výjimečně, protože byl nahrazen chloristanem amonným .
Dusičnan draselný je hlavní složkou černého prášku . Používá se také k uchování použitých potravin .
Síran draselný se používá hlavně jako hnojivo .
Fosforečnan draselný se používá jako přísada do detergentů , jako hnojivo a jako regulátor kyselosti v potravinách .
Dichroman draselný je oranžová sůl. Má tříklinickou krystalovou strukturu v prostorové skupině P 1 (vesmírná skupina č. 2) . V laboratoři se používá jako oxidační činidlo , činidlo pro detekci z peroxidu vodíku a základní titr látky vzhledem ke své dobré skladovatelnosti . Ve strojírenství se používá v koželužství , galvanické pokovování , na zápasy a pro výrobu z kyseliny chromsírová .
Manganistan draselný je kovová, lesklá , téměř černá krystalická pevná látka a silné oxidační činidlo .
Hexacyanoferát draselný (II) vytváří žluté, jednoklonné krystaly . Tím, oxidaci s peroxidem vodíku nebo chloru může být Kaliumhexacyanidoferrat (III) produkován. V potravinářském průmyslu se používá jako separační prostředek a stabilizátor . Může však být použita pouze v malých množstvích v potravinách , jako vodík kyanid mohou tvořit při zahřátí, nebo pokud jsou vystaveny kyselin .
Kyanid draselný (kyanid) je draselná sůl vodíku kyanidu a je také vysoce toxický. Používá se v průmyslových výrobních procesech , kde se používá zejména pro extrakci zlata ( kyanid loužení ) a v galvanických lázních, ale také v organické syntetické chemii pro výrobu z nitrilů .
Kyselý vinan draselný (zubní kámen) je sůl z kyseliny vinné . To je produkováno během skladování z vína nebo hroznové šťávy . Používá se k výrobě kyseliny vinné a spolu s hydrogenuhličitanem sodným jako kypřící činidlo .
Mýdla jsou sodné nebo draselné soli z mastných kyselin . Pro výrobu se tuky vaří s louhem sodným nebo roztokem hydroxidu draselného . Tento proces se nazývá vroucí mýdlo , zmýdelnění chemické reakce . Tuky se štěpí na glycerin a alkalické soli mastných kyselin (skutečná mýdla). Alternativně lze mýdla vyrábět přímo z volných mastných kyselin jejich reakcí s alkáliemi za vzniku jejich solí . Vhodné mastné kyseliny jsou například, kyselina laurová , kyselina myristová , kyselina palmitová , kyselina stearová , kyselina olejová a kyselina ricinolejová .
Individuální důkazy
- ↑ a b Harry H. Binder: Lexikon chemických prvků. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3 .
- ↑ Hodnoty vlastností (informační pole) jsou převzaty z www.webelements.com (draslík) , pokud není uvedeno jinak .
- ↑ CIAAW, Standard Atomic Weights Revised 2013 .
- ↑ a b c d e Záznam o draslíku u Kramida, A., Ralchenko, Yu., Reader, J. and NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1) . Ed.: NIST , Gaithersburg, MD. doi : 10.18434/T4W30F ( https://physics.nist.gov/asd ). Citováno 11. června 2020.
- ↑ a b c d e Záznam o draslíku na WebElements, https://www.webelements.com , přístup 11. června 2020.
- ^ NN Greenwood, A. Earnshaw: Chemie prvků. 1. vydání. VCH, Weinheim 1988, ISBN 3-527-26169-9 , s. 97.
- ↑ Robert C. Weast a kol. (Ed.): CRC Handbook of Chemistry and Physics . CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9 , s. E-129 až E-145. Hodnoty jsou založeny na g / mol a jsou uvedeny v jednotkách CGS. Zde uvedená hodnota je hodnota SI vypočtená z ní bez měrné jednotky.
- ↑ a b Yiming Zhang, Julian RG Evans, Shoufeng Yang: Opravené hodnoty varných bodů a entalpie odpařování prvků v příručkách. In: Journal of Chemical & Engineering Data. 56, 2011, s. 328-337, doi: 10,1021 / je1011086 .
- ^ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Pevné tělo. (= Učebnice experimentální fyziky . Svazek 6). 2. vydání. De Gruyter, Berlin 2005, ISBN 3-11-017485-5 , s. 361.
- ↑ David R. Lide (Ed.): CRC Handbook of Chemistry and Physics . 90. vydání. (Internetová verze: 2010), CRC Press / Taylor and Francis, Boca Raton, FL, Electrochemical Series, s. 8-22.
- ↑ b Zápis draslíku v databázi GESTIS látkové na IFA , k dispozici na 16. prosince 2019. (Vyžadován JavaScript)
- ↑ Vstup na draslík v seznamu klasifikací a označení všech v Evropské agentury pro chemické látky (ECHA), k dispozici na 1. srpna 2016. Výrobci a distributoři mohou rozšířit do harmonizované klasifikace a označování .
- ^ A b Statistiky a informace Potash . Spojené státy geologický průzkum.
- ^ David J. Wishart: Encyklopedie Great Plains . U of Nebraska Press, 2004, ISBN 978-0-8032-4787-1 , s. 433.
- ^ Nová technika nachází plynné kovy v atmosférách Exoplanet wired.com, 31. srpna 2010.
- ↑ Astronomové nacházejí draslík v atmosféře obří planety sciencedaily.com, 1. září 2010, (přístup 20. září 2010).
- ^ AE van Arkel, P. Aßmann, G. Borelius, G. Chaudron, EJ Daniels, R. Gadeau, W. Geibel, W. Graßmann, CR Hayward, G. Jantsch, W. Kroll, K. Lins: Reine Metals: Produkce · Vlastnosti · Použití , vydavatel AE van Arkel, Verlag Springer-Verlag, 2013, ISBN 9783642996955 .
- ↑ Georg Brauer: Volné alkalické kovy . In: Příručka preparativní anorganické chemie . Ferdinand Enke Verlag, Stuttgart 1954, s. 724 ff .
- ^ PE Mason, F. Uhlig, V. Vaněk, T. Buttersack, S. Bauerecker, P. Jungwirth: Coulombův výbuch během raných fází reakce alkalických kovů s vodou. In: Přírodní chemie. Svazek 7, číslo 3, březen 2015, s. 250-254, doi: 10,1038 / nchem.2161 , PMID 25698335 .
- ↑ Freie Universität Berlin , Ústav pro chemii a biochemii likvidaci draslíku ( Memento od 13. prosince 2013 ve webovém archivu archive.today )
- ↑ J. Evers, TM Klapötke , G. Oehlinger: Kůra nebezpečného monohydrátu hydroxidu draselného. In: Chemical & Engineering News , 80 (37), s. 2, 4.
- ↑ GLCM van Rossen, H. van Bleiswijk: O stavovém diagramu slitin draslíku a sodíku. In: Z. anorg. allg. Chem. , 1912, 74, s. 152-156. doi: 10,1002 / zaac.19120740115 .
- ↑ Konrad Mengel: Výživa a metabolismus rostliny. 7. vydání. Fischer, Jena 1991, ISBN 3-334-00310-8 , s. 335-346.
- ↑ Shieh et al: Draselné kanály: molekulární defekty, nemoci a terapeutické příležitosti. V: Pharmacol Rev . 52 (4), prosinec 2000, s. 557-594, PMID 11121510 .
- ^ Tamargo et al: Farmakologie srdečních draslíkových kanálů. In: Cardiovasc Res . 62 (1), 1. dubna 2004, s. 9-33, PMID 15023549 .
- ↑ Niemeyer a kol .: Modulace dvoupórového domény K + kanálu K + citlivého na kyselinu TASK-2 (KCNK5) změnami objemu buněk. In: J Biol Chem . 276 (46), 16. listopadu 2001, s. 43166-43174, PMID 11560934 .
- ↑ Shen a kol .: Izoforma KCC3 kotransportéru KCl3 může hrát důležitou roli v regulaci buněčného růstu. In: Proč Natl Acad Sci USA . 98 (25), 4. prosince 2001, s. 14714-14719, PMID 11724933 .
- ↑ Young a kol .: Determinanty srdeční fibrózy v experimentálních hypermineralokortikoidních stavech In: Am J Physiol-Endocrinol Metab . 269 (4 Pt 1), říjen 1995, s. E657- E662 , PMID 7485478 .
- ↑ Young & Ma: Cévní ochranné účinky draslíku. In: Semin Nephrol . 19, 1999, s. 477-486, PMID 10511387 .
- ↑ Krishna: Účinek příjmu draslíku na krevní tlak. In: J Am Soc Nephrol . 1 (1), červenec 1990, s. 43–52, PMID 2104250 .
- ^ Suter: Draslík a hypertenze. In: Nutr Rev. 56 (5 Pt 1), květen 1998, s. 151-153, PMID 9624886 .
- ↑ Young et al: Ochranné mechanismy kardiovaskulárního systému draslíku. In: Am J Physiol-Regul Integr Comp Physiol . 268 (4 Pt 2), duben 1995, s. R825-R837, PMID 7733391 .
- ^ Tannen: Vliv draslíku na krevní tlak. In: Kidney Int Suppl . 22, 1987, s. S242-S248, PMID 3323616 .
- ↑ Frassetto et al.: Strava, evoluce a stárnutí-patofyziologické efekty post-zemědělské inverze poměrů draslíku k sodíku a báze k chloridu v lidské stravě. In: Eur J Nutr. 40 (5), říjen 2001, s. 200-213, PMID 11842945 .
- ↑ Frassetto a kol.: Odhad čisté produkce endogenních nekarbonových kyselin u lidí z dietního obsahu draslíku a bílkovin. In: Am J Clin Nutr. 68 (3), září 1998, s. 576-583, PMID 9734733 .
- ↑ Frassetto a kol.: Hydrogenuhličitan draselný snižuje vylučování dusíku močí u postmenopauzálních žen. In: J Clin Endocrinol Metab . 82 (1), leden 1997, s. 254-259, PMID 8989270 .
- ↑ Manz et al.: Faktory ovlivňující schopnost ledvin vylučovat vodíkové ionty u zdravých dětí. In: Pediatr Nephrol . 16 (5), květen 2001, s. 443-445, PMID 11405120 .
- ↑ Remer a kol .: Potenciální dietní zátěž kyselinou ledvinovou a vylučování čisté kyseliny ledvinami u zdravých, volně žijících dětí a mladistvých. In: Am J Clin Nutr. 77 (5), květen 2003, s. 1255-1260, PMID 12716680 .
- ^ Poznámka: Vliv stravy na acidobazickou rovnováhu. In: Semin Dial. 13 (4), Jul-Aug 2000, pp. 221-226, PMID 10923348 .
- ↑ Tannen: Účinek draslíku na okyselení ledvin a acidobazickou homeostázu. In: Semin Nephrol . 7 (3), září 1987, s. 263-273, PMID 2825318 .
- ↑ Evropský úřad pro bezpečnost potravin : EFSA Journal. 8 (2), 2010, s. 1469.
- ↑ Federální institut pro hodnocení rizik : Používání minerálů v potravinách: toxikologické a fyziologické aspekty .
- ↑ Curhan et al.: Srovnání dietního vápníku s doplňkovým vápníkem a dalšími živinami jako faktory ovlivňující riziko vzniku ledvinových kamenů u žen. In: Ann Intern Med . 126 (7), 1. dubna 1997, s. 497-504. PMID 9092314 .
- ↑ Hirvonen a kol .: Příjem živin a používání nápojů a riziko ledvinových kamenů u mužských kuřáků. In: Am J Epidemiol. 150 (2), 15. července 1999, s. 187-194. PMID 10412964 .
- ↑ Keßler & Hesse: Křížová studie vlivu minerální vody bohaté na bikarbonáty na složení moči ve srovnání s citrátem sodno-draselným u zdravých mužských subjektů. In: Br J Nutr. 84 (6), prosinec 2000, s. 865-871. PMID 11177203 .
- ↑ Macdonald et al.: Nutriční asociace se ztrátou kostní hmoty během přechodu v menopauze: důkaz příznivého účinku živin vápníku, alkoholu a ovoce a zeleniny a škodlivého účinku mastných kyselin. In: Am J Clin Nutr. 79 (1), leden 2004, s. 155-165. PMID 14684412 .
- ↑ Morris a kol .: Rozdílné účinky doplňkových KCl a KHCO3: patofyziologické a klinické důsledky. In: Semin Nephrol. 19 (5), září 1999, s. 487-493. PMID 10511388 .
- ↑ Sellmeyer et al: Citrát draselný brání zvýšenému vylučování vápníku močí a resorpci kostí vyvolané dietou s vysokým obsahem chloridu sodného. In: J Clin Endocrinol Metab. 87 (5), květen 2002, s. 2008-2012. PMID 11994333 .
- ^ A b Suter: Účinky draslíku, hořčíku, vápníku a vlákniny na riziko mrtvice. In: Nutr Rev. 57 (3), březen 1999, s. 84-88. PMID 10101922 .
- ↑ a b Institut Maxe Rubnera, Federální výzkumný ústav pro výživu a potraviny (2008) Národní studie spotřeby II. Zpráva o výsledcích část 2. Celostátní průzkum o výživě mladistvých a dospělých. ( Memento ze dne 28. prosince 2013 v internetovém archivu ) (PDF; 3,3 MB).
- ↑ a b Eaton et al.: Paleolitická výživa přehodnocena: dvanáctiletá retrospektiva její podstaty a důsledků. In: Eur J Clin Nutr. 51 (4), 1997, s. 207-216. PMID 9104571 .
- ^ P. Elliott, I.Brown: Příjem sodíku po celém světě. Podkladový dokument připravený pro fórum a technické setkání o omezení příjmu soli v populacích (5. – 7. Října 2006 v Paříži) . (PDF; 2,2 MB).
- ↑ a b Světová zdravotnická organizace: Pokyny: Příjem draslíku pro dospělé a děti. Ženeva 2012. (PDF; 564 kB).
- ^ Světová zdravotnická organizace: Globální strategie ve stravě, fyzické aktivitě a zdraví. Populační strategie redukce sodíku . Citováno 13. prosince 2013.
- ↑ Suter a kol .: Nutriční faktory při kontrole krevního tlaku a hypertenze. In: Nutr Clin Care. 5 (1), leden-únor 2002, str. 9-19, PMID 12134718 .
- ↑ Tobian: Dietní chlorid sodný a draslík mají vliv na patofyziologii hypertenze u lidí a zvířat. In: Am J Clin Nutr. 65 (2 Suppl), únor 1997, s. 606S-611S, PMID 9022555 .
- ↑ Bazzano et al: Příjem draslíku ve stravě a riziko cévní mozkové příhody u mužů a žen v USA: Národní průzkum zdraví a výživy Výzkum I epidemiologická následná studie. In: Tah. 32 (7), červenec 2001, s. 1473-1480, PMID 11441188 .
- ↑ Ascherio a kol.: Příjem draslíku, hořčíku, vápníku a vlákniny a riziko mrtvice mezi muži z USA. In: Circulation. 98 (12), 22. září 1998, s. 1198-1204, PMID 9743511 .
- ↑ Barri & Wingo: Účinky vyčerpání a suplementace draslíku na krevní tlak: klinický přehled. In: Am J Med Sci. 314 (1), červenec 1997, s. 37–40, PMID 9216439 .
- ↑ Geleijnse a kol.: Elektrolyty jsou spojeny s krevním tlakem ve stáří: Rotterdamská studie. In: J Hum Hypertens. 11 (7), červenec 1997, s. 421-423, PMID 9283057 .
- ↑ Khaw & Barrett-Connor: Dietní draslík a krevní tlak v populaci. In: Am J Clin Nutr. 39 (6), červen 1984, s. 963-968, PMID 6720624 .
- ↑ Khaw & Barrett-Connor: Dietní vláknina a snížená úmrtnost na ischemické choroby srdeční u mužů a žen: 12letá prospektivní studie. In: Am J Epidemiol. 126 (6), prosinec 1987, str. 1093-1102 , PMID 2825519 .
- ↑ Siani et al.: Řízená studie dlouhodobých perorálních doplňků draslíku u pacientů s mírnou hypertenzí. In: Br Med J (Clin Res Ed). 294 (6585), 6. června 1987, str. 1453-1456, PMID 3300841 .
- ↑ Svetkey et al.: Dvojitě zaslepená, placebem kontrolovaná studie chloridu draselného při léčbě mírné hypertenze. In: Hypertenze. 9 (5), květen 1987, s. 444-450, PMID 3570421 .
- ↑ Sacks a kol.: Účinky sníženého sodíku v potravě na dietu a dietní přístupy k zastavení hypertenze (DASH) na krevní tlak. Skupina DASH-Sodium Collaborative Research Group. In: N Engl J Med . 344 (1), 4. ledna 2001, s. 3-10, PMID 11136953 .
- ↑ Vollmer a kol.: Nové poznatky o účincích diet na nízký obsah soli a vysoký obsah ovoce a zeleniny a nízkotučných mléčných výrobků na krevní tlak. In: Curr Control Trials Cardiovasc Med. 2 (2), 2001, str. 71-74, PMID 11806776 .
- ↑ Zemel: Dietní schéma a hypertenze: studie DASH. Dietní přístupy k zastavení hypertenze. In: Nutr Rev. 55 (8), srpen 1997, s. 303-305, PMID 9287480 .
- ↑ Federální institut pro hodnocení rizik: Používání minerálů v potravinách.
- ↑ Evropský úřad pro bezpečnost potravin: EFSA Journal. 8 (2), 2010, s. 1469.
- ↑ Harrington, Cashman: Zdá se, že vysoký příjem soli zvyšuje resorpci kostí u postmenopauzálních žen, ale vysoký příjem draslíku tento nepříznivý účinek zmírňuje. In: Nutr Rev. 61 (5 Pt 1), květen 2003, s. 179-183, PMID 12822707 .
- ↑ Lemann et al.: Podávání draslíku snižuje a deprivace draslíku zvyšuje vylučování vápníku močí u zdravých dospělých. In: Kidney Int. 39 (5), květen 1991, s. 973-983, PMID 1648646 .
- ↑ New et al.: Nižší odhady čisté produkce endogenních nekarbonových kyselin jsou pozitivně spojeny s indexy zdraví kostí u premenopauzálních a perimenopauzálních žen. In: Am J Clin Nutr. 79 (1), leden 2004, s. 131-138. PMID 14684409 .
- ↑ Barzel: Kostra jako systém iontové výměny: důsledky pro roli acidobazické nerovnováhy při vzniku osteoporózy. In: J Bone Miner Res . 10 (10), říjen 1995, s. 1431-1436, PMID 8686497 .
- ↑ Frassetto a kol.: Vliv věku na složení acidobazické krve v krvi u dospělých lidí: role poklesu funkce ledvin související s věkem. In: Am J Physiol. 271 (6 Pt 2), prosinec 1996, s. F1114-F1122, PMID 8997384 .
- ↑ Lemann: Vztah mezi vylučováním vápníku močí a čistou kyselinou, jak je určeno dietními bílkovinami a draslíkem: přehled. In: Nephron. 81 Suppl 1, 1999, s. 18-25, PMID 9873210 .
- ↑ Massey: Dietní živočišné a rostlinné bílkoviny a lidské kosti: přístup založený na celých potravinách. In: J Nutr. 133 (3), březen 2003, s. 862S-865S, PMID 12612170 .
- ↑ Morris a kol .: Rozdílné účinky doplňkových KCl a KHCO 3 : patofyziologické a klinické důsledky. In: Semin Nephrol. 19 (5), září 1999, s. 487-493, PMID 10511388 .
- ^ Remer a Manz: Nezapomeňte na stav kyselé báze při studiu metabolických a klinických účinků nedostatku draslíku v potravě. In: J Clin Endocrinol Metab. 86 (12), prosinec 2001, s. 5996-5997, PMID 11739479 .
- ^ Poznámka: Vliv stravy na acidobazickou rovnováhu. In: Semin Dial. 13 (4), Jul-Aug 2000, pp. 221-226, PMID 10923348 .
- ↑ a b S. Jehle et al.: Částečná neutralizace acidogenní západní stravy citrátem draselným zvyšuje kostní hmotu u postmenopauzálních žen s osteopenií. In: J Am Soc Nephrol. 17, 2006, s. 3213-3222 , PMID 17035614 .
- ↑ M. Marangella et al.: Účinky suplementace citrátu draselného na kostní metabolismus. In: Calcif Tissue Int. 74, 2004, s. 330-335, PMID 15255069 .
- ↑ DE Sellmeyer a kol.: Citrát draselný brání zvýšenému vylučování vápníku močí a resorpci kostí vyvolané dietou s vysokým obsahem chloridu sodného. In: J Clin Endocrinol Metab. 87, 2002, s. 2008-2012, PMID 11994333 .
- ↑ Národní databáze živin USDA pro standardní reference, vydání 24 Obsah vybraných potravin podle běžného opatření, draslík, K (mg) seřazeno podle obsahu živin ( Memento z 5. dubna 2013 v internetovém archivu ) (PDF; 150 kB).
- ↑ sušená meruňka . Web německé poradenské a informační sítě pro výživu. Citováno 21. října 2012.
- ↑ Dieta s nízkým obsahem draslíku - praktické tipy .
- ↑ Federální úřad pro ochranu před zářením: Které radionuklidy se nacházejí v potravinách? Citováno 19. srpna 2014.
- ^ C. Michael Lederer, Jack M. Hollander, Isadore Perlman : Tabulka izotopů, John Wiley & Sons , New York, 1967.
- ↑ Draslík-40-s poločasem rozpadu 1,28 miliardy let, dlouhotrvající a radioekologicky relevantní
- ↑ Livechart - Tabulka nuklidů - Data o jaderné struktuře a rozpadu. Citováno 11. února 2020 .
- ↑ Tabulka nuklidů. Citováno 11. února 2020 .
- ^ Andreas Hermann: Prvky mohou být pevné i tekuté současně. In: News - University of Edinburgh . 9. dubna 2019, přístup 10. dubna 2019 .
- ↑ a b Karl Cammann (Ed.): Instrumentální analytická chemie. Spektrum, Heidelberg 2001, ISBN 3-8274-0057-0 , s. 4-60.
- ^ AF Holleman , E. Wiberg , N.Wiberg : Učebnice anorganické chemie . 102. vydání. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , s. 1286.
- ^ A b A. F. Holleman , E. Wiberg , N. Wiberg : Učebnice anorganické chemie . 101. vydání. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9 , s. 1176.
- ↑ Vstup na chlorid draselný v databázi GESTIS látkové na IFA , k dispozici na 17. prosince 2019. (Vyžadován JavaScript)
- ↑ S.-P. Ballstaedt, P. Reinhard, M. Rentschler, E. Rottländer, AA Bodenstedt, D. Briesen, A. Bruckhaus, J. Büschenfeld, A. Hauptmann, DA Hiller: Změna půd prostřednictvím antropogenních vlivů: interdisciplinární studijní kniha , Verlag Springer Berlin Heidelberg, 1997, ISBN 3-540-61556-3
- ^ AF Holleman , E. Wiberg , N.Wiberg : Učebnice anorganické chemie . 101. vydání. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9 , s. 1170.
- ↑ Zápis hydroxidu draselného v databázi GESTIS látkové na IFA , k dispozici na 17. prosince 2019. (Vyžadován JavaScript)
- ↑ Y. Idemoto, JW Richardson, N.Koura, S.Kohara, CK Loong: Krystalová struktura (Li x K 1-x ) 2 CO 3 (x = 0,0,43,0,5,0,62,1) neutronovou práškovou difrakcí analýza. In: Journal of Physics and Chemistry of Solids , 59, 1998, str. 363-376, doi: 10,1016 / S0022-3697 (97) 00209-6 .
- ↑ JK Brandon, ID Brown: Přesné stanovení krystalové struktury triklinického dvojchromanu draselného, K 2 Cr 2 O 7 . In: Canadian Journal of Chemistry . páska 46 , č. 6 , 15. března 1968, s. 933-941 , doi : 10,1139 / v68-155 ( PDF ).
- ↑ Axel Trautmann, Jörg Kleine -Tebbe: Alergologie v klinice a praktické alergeny - diagnostika - terapie . Georg Thieme Verlag, 2013, ISBN 978-3-13-159352-8 , s. 227 ( omezený náhled ve vyhledávání knih Google).
- ↑ Hans-Dieter Jakubke, Ruth Karcher (Ed.): Lexicon of Chemistry , Akademické nakladatelství Spectrum, Heidelberg, 2001.