Exotermická reakce
Chemická reakce je exotermní , pokud se uvolní více energie, než bylo původně dodáván jako aktivační energie . (Název pochází z řeckého ἔξω exo „venku“ a θερμός thermós „teplý“, „horký“, „vyhřívaný“).
Tyto produkty exotermní reakci mají nižší entalpii než výchozích látek ; entalpie reakce exotermní reakci je tedy negativní.
Pokud reakce probíhá za konstantního tlaku (tj. Za isobarických podmínek), je pokles entalpie číselně roven množství vydávaného tepla ( podrobnější vysvětlení viz → Entalpie ). V isobarickém případě jsou exotermické reakce přesně ty, při nichž se teplo vydává do okolí.
Občas jsou exotermické reakce také definovány plošně jako reakce, které vydávají teplo. V isobarickém případě jsou obě definice identické, ale obecně to nepřekračuje. Pokud reakce probíhá například při konstantním objemu, odpovídá množství vydávaného tepla změně vnitřní energie systému, nikoli změně entalpie ( podrobnější vysvětlení viz → Entalpie ). V následujícím textu tento článek používá definici použitou na začátku jako reakci s negativní entalpií reakce. Tato definice má tu výhodu, že entalpie je stavová proměnná , takže znalost počátečního a konečného stavu je dostatečná k určení změny entalpie. Vydané teplo je na druhou stranu proměnnou procesu a je obecně nutné znát podrobnosti o průběhu procesu, aby bylo možné jej vypočítat.
Opakem exotermní reakce je endotermická reakce , jejíž entalpie reakce je pozitivní a která v isobarickém případě absorbuje množství tepla odpovídající zvýšení entalpie. Pokud je uvažovaná reakce exotermická, pak je reverzní reakce endotermická a naopak.
Pokud reakce probíhá v adiabatické nádobě, takže nemůže docházet k výměně tepla s okolním prostředím, vede exotermická reakce ke zvýšení teploty a endotermická reakce ke snížení teploty.
Ve fyzice se jaderná reakce, při které se uvolňuje energie, nazývá exotermická. Exotermická jaderná fúze je například spalování vodíku , jak se to děje na slunci . Štěpení uranu je například také silně exotermické .
Příklady
Typické exotermické reakce jsou:
- Oheň ( hořící )
- Tuhnutí (= kalení) betonu .
- Po krátkém zahřátí železo a síra reagují s vývojem světla a tepla za vzniku sirníku železa
Například míchání látek ( teplo směsi ) nebo adsorpce a absorpce látek na aktivním uhlí nebo zeolitech jsou často exotermické, i když v mnohem menší míře .
Exotermické a exergonické reakce

Na první pohled se zdá rozumné předpokládat, že exotermické reakce jsou přesně ty reakce, které probíhají dobrovolně, a že čím více tepla se uvolňuje, tím násilnější jsou. V mnoha případech se chemické reakce skutečně chovají tímto způsobem. V prvních letech termochemie tato zkušenost vedla k formulaci principu Thomsenem a Berthelotem . Toto empirické - ale ne přísně platné - pravidlo říká: Pokud jsou reaktanty spojeny za isobarických a izotermických podmínek, aby mohla proběhnout chemická reakce, pak výsledný nový rovnovážný stav je charakterizován skutečností, že proces vedoucí k němu uvolňuje více tepla než jakýkoli jiný možný proces Proces. Jinými slovy: ze všech možných procesů je realizován ten nejexotermnější. Princip je také synonymem pro tvrzení, že díky implementovanému procesu je rozdíl v entalpii co největší a tím i výsledná entalpie co možná nejmenší.
Existence dobrovolných expirujících endo Thermerových reakcí (např. Odpařující se kapalina) však ukazuje, že tento princip nemůže požadovat univerzální platnost. Skutečným kritériem je: přesně takové reakce probíhají dobrovolně, což vede ke zvýšení celkové entropie systému a jeho okolí. Za isobarických a izotermických podmínek je toto kritérium maximální entropie synonymem pro minimalizaci volné energie systému. Reakce, která snižuje Gibbsovu energii systému, se nazývá exergonická reakce. Rozdíl mezi dobrovolně a nedobrovolně se vyskytujícími reakcemi je synonymem rozdílu mezi exergonickými a endergonickými reakcemi .
Příkladem endotermické, ale přesto dobrovolné chemické reakce je rozklad oxidu dusného na oxid dusnatý a oxid dusičitý :
Entalpie reakce tohoto rozpadu je pozitivní, takže reakce je endotermická. Gibbsova reakční energie je negativní, takže reakce je exergonická.
Změna Gibbsovy energie probíhá za izotermických podmínek
- .
Při nízkých teplotách a minimalizaci Gibbsovy energie je přibližně ekvivalentní minimalizaci entalpie systému. V tomto případě jsou exergonické reakce většinou také exotermické reakce a princip Thomsena a Berthelota předpovídá stavy rovnováhy přibližně správně s ohledem na změnu entalpie. I při vyšších teplotách (například při pokojové teplotě) zůstává princip přibližně správný, protože teplotní závislosti a při teplotách, které nejsou příliš vysoké, jsou podobné (jak lze ukázat s přihlédnutím ke třetímu zákonu ) a podobnost a proto se s nárůstem teploty udržuje i při větším teplotním rozsahu.
Pokud je však reakce doprovázena dostatečně velkým zvýšením entropie (jako ve výše zmíněných případech odpařující se kapaliny nebo rozkladu oxidu dusného), může se stát, že tento výraz převládá a reakce probíhá dobrovolně (exergonicky ) , i když se jeho entalpie zvyšuje (endotermická, ), reakce ve smyslu entalpie „běží do kopce“.
postup
I když je reakce exergonická, tj. Probíhá dobrovolně z energetického hlediska, nezaručuje to, že začne probíhat nezávisle i bez vnějšího podnětu. Příkladem toho je reakce uhlíku s kyslíkem za vzniku oxidu uhličitého :
Tato spalovací reakce je exergonická ( ). Hrudka uhlí se však nerozhoří při pouhém kontaktu s kyslíkem ve vzduchu; nejprve musí být zapálen. Spalování pak pokračuje nezávisle.
V takových případech nejsou reaktanty původně v reaktivním stavu. Vazby musí být často rozbity, než mohou být znovu vytvořeny v novém uspořádání - v tomto případě v molekule. K tomu obvykle dochází, když se srazí dva zúčastněné atomy nebo molekuly. Během interakce během srážky se nejprve natáhnou původní vazby, pro které je třeba vynaložit energii. Kolidující částice jsou krátce přítomny jako takzvaný aktivovaný komplex , jehož entalpický obsah je větší než obsah jednotlivých částic dohromady; entalpie obvykle pochází z tepelného pohybu částic. Pokud má aktivovaný komplex dostatek entalpie k úplnému rozbití dotyčných vazeb (tzv. Aktivační entalpie), pak může proběhnout reakce. Jinak reakce neprobíhá, i když by to bylo termodynamicky možné - je „kineticky inhibováno“ - a reaktanty zůstávají v počátečním metastabilním stavu. V tomto případě lze reakci zahájit, pouze pokud je do systému dodána dostatečná dodatečná energie, obvykle ve formě tepelné energie.
V případě exotermické reakce může tato tepelná energie pocházet ze samotné reakce. Pokud reakce uvolní dostatek entalpie, je po zahájení soběstačná.
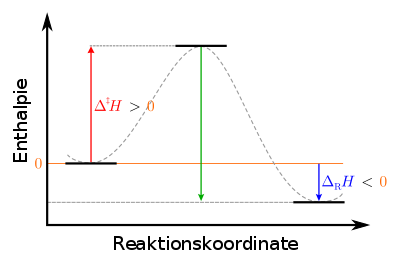
|
Legenda : vlevo: počáteční stav výchozích materiálů: metastabilní centrum: přechodový stav aktivovaného komplexu: nestabilní vpravo: konečný stav produktů: stabilní |
U endotermické reverzní reakce je aktivační entalpie, která se má použít, větší než u dopředné reakce, a to součet aktivační entalpie a reakční entalpie dopředné reakce, jak je patrné také z diagramu.
Nukleární fyzika
Termín exotermní se také používá pro jaderné reakce . Uvádí, že energie se uvolňuje během reakce, ke které dochází jako kinetická energie reakčních produktů. Technicky důležité exotermické jaderné reakce jsou neutronem indukované štěpení jader a fúze izotopů vodíku.
Individuální důkazy
- ↑ Vstup na exotermickou reakci . In: IUPAC Kompendium chemické terminologie („Zlatá kniha“) . doi : 10.1351 / goldbook.E02269 Verze: 2.3.3.
- ^ PW Atkins: Fyzikální chemie. 2. dotisk d. 1. vydání. VCH, Weinheim 1990, ISBN 3-527-25913-9 , s. 85: „Reakce, při nichž se ΔH > 0 nazývají endotermické, reakce s ΔH <0 se nazývají exotermní.“
- ^ E. Keszei: Chemická termodynamika. Springer, Berlin / Heidelberg 2012, ISBN 978-3-642-19863-2 , s. 222: „[...] pro exotermní reakce (pro které je Δ r H ° negativní) [...] pro endotermní reakce ( pro které je Δ r H ° kladný) [...] "
- ↑ a b Vstup na entalpii. In: Römpp Online . Georg Thieme Verlag, zpřístupněno 11. července 2017.
- ^ PW Atkins, J. de Paula: Fyzikální chemie. 5. vydání, Wiley-VCH, Weinheim 2013, ISBN 978-3-527-33247-2 , s. 46: „Proces, při kterém se uvolňuje energie ve formě tepla, se nazývá exotermický. [...] Procesy, ke kterým je třeba přidat tepelnou energii, se nazývají endotermické. “
- ^ PW Atkins: Fyzikální chemie. 2. dotisk d. 1. vydání. VCH, Weinheim 1990, ISBN 3-527-25913-9 , s. 85
- ↑ HB Callen: Termodynamika a úvod do termostatistiky. 2. vydání. John Wiley & Sons, New York 1985, ISBN 0-471-86256-8 , s. 277.
- ^ AF Holleman , N. Wiberg : Anorganická chemie . 103. vydání. Svazek 1: Základy a prvky hlavní skupiny. Walter de Gruyter, Berlín / Boston 2016, ISBN 978-3-11-049585-0 , s. 53 (Ukázka čtení: Část A - Základy chemie vodíku. Vyhledávání knih Google ). .
- ↑ HB Callen: Termodynamika a úvod do termostatistiky. 2. vydání. John Wiley & Sons, New York 1985, ISBN 0-471-86256-8 , s. 278.
- ^ PW Atkins: Fyzikální chemie. 2. dotisk d. 1. vydání. VCH, Weinheim 1990, ISBN 3-527-25913-9 , s. 860.
- ^ PW Atkins: Fyzikální chemie. 2. dotisk d. 1. vydání. VCH, Weinheim 1990, ISBN 3-527-25913-9 , s. 764.
- ^ L. Pauling: Obecná chemie. Dover, New York 1988, ISBN 0-486-65622-5 , s. 567.























