Cyklus kyseliny citronové
| Rodič |
| Acetyl CoA katabolismus |
| Genová ontologie |
|---|
| QuickGO |
Kyseliny citronové cyklus (také citrátový cyklus , kyselina citrónová cyklus , kyselina cyklus trikarboxylových , Krebsův cyklus nebo Szent-Györgyi-Krebsův cyklus ) je cyklus biochemických reakcí, který hraje důležitou roli v metabolismu (metabolismus) ze aerobních buněk z živých bytostí a hlavně pro oxidační štěpení organických látek Využívá se účel výroby energie a poskytování meziproduktů pro biosyntézu. Acetyl-CoA, který je vytvořen jako meziprodukt při tuky , cukry , alkohol a aminokyseliny jsou rozděleny se člení na oxid uhličitý (CO 2 ) a vodu (H 2 O). Jsou vytvářeny meziprodukty, které lze použít k vybudování organických složek těla živé bytosti ( anabolismus ), a také je k dispozici přímá a nepřímá energie v biochemicky dostupné formě (jako adenosintrifosfát ATP).
Cyklus kyseliny citronové probíhá v eukaryotech v matrici mitochondrií u prokaryot v cytoplazmě z. Opačný sled reakcí probíhá v takzvaném redukčním cyklu kyseliny citronové , který některé bakterie používají k asimilaci oxidu uhličitého .
etymologie
To je pojmenované po výsledného meziproduktu citrátu je anion z kyseliny citrónové . Reakční sekvence je známá také jako Krebsův cyklus podle objevitele Hanse A. Krebse (1900–1981) . Kromě Fritze Alberta Lipmanna získal Krebs v roce 1953 Nobelovu cenu za medicínu za objasnění metabolických metabolických cest.
objev
V roce 1937 biochemik Hans Adolf Krebs (ve spolupráci s Williamem Arthurem Johnsonem) jako první postuloval citrátový cyklus jako cestu oxidace pyruvátu . Krebs zkoumal vliv různých organických kyselin na spotřebu kyslíku během oxidace pyruvátu pomocí suspenzí drceného svalu holubího prsu. Tento letový sval je zvláště vhodný pro vyšetření, protože má vysokou oxidační aktivitu díky velmi vysoké rychlosti dýchání. Krebs potvrdil mimo jiné pozorování Alberta Szent-Györgyiho , že C4 - dikarboxylové kyseliny ze zvířecích tkání ( sukcinát , L - malát , fumarát a oxaloacetát ) stimulují spotřebu kyslíku ve svalech. Krebs toto pozorování potvrdil a zjistil, že oxidace pyruvátu také způsobila takový účinek. Příkladem je citrát C6 trikarboxylových kyselin, cis - akonitát a isocitrát , stejně jako stimulovaná sloučenina C5 a-ketoglutarát . U ostatních organických kyselin se uvedený účinek neprojevil. To však bylo nesmírně významné, protože velmi malá množství již vedla k oxidaci vícenásobného množství pyruvátu.
Druhým důležitým pozorováním rakoviny bylo, že malonát - úzce související se sukcinátem a kompetitivním inhibitorem sukcinátdehydrogenázy - inhibuje aerobní využití pyruvátu ve svalových suspenzích, bez ohledu na to, která z aktivních organických kyselin je přidána. To ukazuje, že sukcinát a sukcinát dehydrogenáza musí být základními složkami reakce, která se účastní oxidace pyruvátu.
Z těchto základních pozorování a dalších důkazů dospěl Krebs k závěru, že aktivní tri- a dikarboxylové kyseliny uvedené níže mohou být uspořádány v chemicky logickém pořadí. Protože inkubace pyruvátu a oxaloacetátu s drcenou svalovou tkání způsobila akumulaci citrátu v médiu, dospěl Krebs k závěru, že tato sekvence nefunguje lineárně, ale cyklicky - její konec je spojen se svým začátkem. Mýlil se jen ohledně poslední chybějící odpovědi. Neplatí následující: pyruvát + oxaloacetát → citrát + CO 2 . Krebs tedy navrhl, že cesta, kterou nazval „cyklus kyseliny citronové“, je hlavní cestou oxidace sacharidů ve svalech.
Role v metabolismu
Produkty rozkladu různých živin, které se štěpí v metabolismu, proudí do cyklu kyseliny citronové. Acetyl-CoA, kyselina octová vázaná na koenzym A , lze popsat jako centrální produkt rozpadu různých tříd živin. Molekuly acetyl-CoA se tvoří přímo z mastných kyselin, například prostřednictvím β-oxidace . Při glykolýze se sacharidy štěpí na pyruvát (kyselinu pyrohroznovou), který je pak dekarboxylován na acetát komplexem pyruvátdehydrogenázy a acetylový zbytek se váže na koenzym A. Nakonec se proteiny také hydrolyzují na aminokyseliny, které se po deaminaci mohou převést na odpovídající a- ketokyseliny , například a-ketoglutarát z kyseliny L - glutamové nebo oxaloacetát z L- aspartátu. Tyto ketokyseliny jsou často meziprodukty v cyklu kyseliny citronové a proudí přímo do něj.
Když se acetyl-CoA štěpí cyklem kyseliny citronové, získává se energie ve formě GTP a také redukčních činidel ( NADH , FADH 2 ). Během těchto procesů se acetylový zbytek acetyl-CoA postupně rozkládá na oxid uhličitý a vodu. Tyto elektrony získané v kyselém cyklu citronové a vázané na koenzymů (NAD + a FAD) jsou přiváděny do dýchacího řetězce a přenesen do konečného příjemce elektronů kyslík (O 2 ). Uvolněná energie se používá k tvorbě ATP.
Cyklus kyseliny citronové také slouží jako dodavatel různých prekurzorových molekul pro anabolismus . Například a-keto kyseliny mohou být odstraněny z cyklu za vzniku aminokyselin nebo jiných látek. Oxaloacetát lze také přivádět zpět do glukoneogeneze.
postup
U eukaryot probíhá cyklus kyseliny citronové v mitochondriích , u prokaryot v cytoplazmě nebo, je-li to nutné, u mitochondriálních ekvivalentů. Jedná se o amfibolický metabolický proces, tj. to znamená, že může sloužit jak anabolickým, tak katabolickým cestám. Cyklus kyseliny citronové je součástí procesů oxidační degradace a předchází dýchacímu řetězci v aerobních organismech.
Cyklus kyseliny citronové lze považovat za třetí ze čtyř kroků v katabolismu sacharidů. Probíhá po glykolýze a oxidační dekarboxylaci pyruvátu na acetyl-CoA, ale před konečnou oxidací v dýchacím řetězci .
Pro cyklus kyseliny citronové lze sestavit následující čistý zůstatek:
Acetyl-CoA, kyselina octová vázaná na koenzym A, známá také jako „aktivovaná“ kyselina octová, se štěpí na oxid uhličitý (CO 2 ), vodík (ten je vázán na nosiče vodíku / elektronů NADH a FADH 2 ) a koenzym A cyklem kyseliny citronové . Zde je guanosin difosfát (GDP) fosforylován na guanosin trifosfát (GTP).
V dýchacím řetězci jsou elektrony vázané na NADH a FADH 2 (8 redukčních ekvivalentů na acetyl-CoA ) přeneseny na kyslík jako terminální akceptor elektronů. Energie uvolněná během migrace elektronů dýchacím řetězcem z proteinového komplexu do proteinového komplexu a nakonec do kyslíku je využitelná transportem protonů z nitra mitochondrie (matrice) do mezimembránového prostoru a tím vytváří potenciální rozdíl, chemiosmotický potenciál AP, pomocí protonového gradientu je tvořena. Díky tomuto potenciálu ATP syntáza nakonec fosforyluje ADP na ATP. Anaerobní organismy nemohou nechat úplně běžet cyklus kyseliny citronové; je v nich přerušen. Je to proto, že jim chybí komplex α-ketoglutarát dehydrogenázy pro přeměnu a-ketoglutarátu na sukcinyl-CoA, nebo je to potlačeno.
Když se 2 pyruvát rozloží acetyl-CoA a cyklem kyseliny citronové a také oxidací odštěpeného vodíku (20 redukčních ekvivalentů) v dýchacím řetězci, poskytuje 25 ATP podstatně více energie než při glykolýze glukózy až do 2 pyruvát, ve kterém se tvoří pouze 2 ATP.
Částečné reakce

Reakční sekvence je uvedena na obrázku výše. Výchozím bodem cyklu kyseliny citronové je přidání acetyl-CoA k oxaloacetátu katalyzované citrátsyntázou a následná hydrolýza za vzniku citrátu ( 1 ). Je-li to nutné, je citrát z cyklu odebrán a zaveden do biosyntézy cholesterolu nebo syntézy mastných kyselin . Tyto procesy probíhající v cytosolu vyžadují acetyl-CoA, který - na rozdíl od citrátu - není schopen projít mitochondriální membránou, ale může být syntetizován z citrátu ( citrátový člun ). Acetyl-CoA pro cyklus kyseliny citronové může pocházet z různých zdrojů, například z β-oxidace mastných kyselin.
Následná izomerace 2a-b citrátu akonitázou poskytne isocitrát . Důležitost tohoto kroku spočívá v přeměně těžko oxidovatelného terciárního alkoholu (citrátu) na snadno oxidovatelný sekundární alkohol (isocitrát).
Isocitrát je oxidován a dekarboxylován isocitrát dehydrogenázou v krocích 3a-b . Kromě prvního redukčního ekvivalentu NADH se tvoří α-ketoglutarát (jiný název: 2-oxoglutarát), což je meziprodukt, který je také důležitý pro metabolismus aminokyselin ( kataplerotická metabolická cesta: redukční transaminace na L - glutamát ⇒ biosyntéza aminokyselin; anaplerotická metabolická cesta: deaminace glutamátu ⇒).
Následující reakce 4 , která kromě NADH dodává druhou molekulu CO 2 prostřednictvím oxidační dekarboxylace , je katalyzována komplexem α-ketoglutarát dehydrogenázy , který je funkčně a strukturně podobný komplexu pyruvát dehydrogenázy. Experimenty s isotopicky značených substrátů ukazují, že CO 2 uvolněna v procesu nelze přiřadit k uhlíku karbonylové skupiny na acetyl-CoA, ale, stejně jako ze stupně 3b, pochází z oxalacetátu.
Výsledný sukcinyl-CoA je dalším klíčovým produktem cyklu kyseliny citronové ( kataplerotická metabolická cesta: biosyntéza porfyrinu ; anaplerotické metabolické cesty: degradace aminokyselin L - valin , L - isoleucin a L - methionin , oxidace lichých mastných kyselin. , viz také oxidace mastných kyselin ).
Prostředky katalyzované hydrolýzou sukcinyl-CoA syntetázy hydrolýzou 5 vysokoenergetického thioesteru sukcinyl-CoA na sukcinát jsou jediným energetickým ekvivalentem cyklu kyseliny citronové ve formě GTP. Nukleosiddifosfátkináza může převádět GTP na ATP.
V kroku 6 je sukcinát substrátem sukcinátdehydrogenázy , který oxidací poskytuje třetí redukční ekvivalent ve formě FADH 2 a také fumarátu , ke kterému rovněž dochází anaplerotickou metabolickou cestou štěpením aminokyselin L - kyselina asparagová Jsou přiváděny L - fenylalanin a L - tyrosin v cyklu kyseliny citronové.
Fumaráza katalyzuje stereospecifické přidání vody k dvojné vazbě fumarátu v kroku 7 , takže vzniká L - malát . V kroku 8 přeměňuje malátdehydrogenáza L-malát na substrát prvního kroku, oxaloacetát, se zpětným získáním NADH. Tím se cyklus uzavře. Další metabolické cesty jsou spojeny s oxaloacetátem (kataplerotický: redukční transaminace na aspartát ⇒ biosyntéza aminokyselin; anaplerotický: deaminace aspartátu ⇒ oxidace aminokyselin).
| Podklad | Reaktanty / koenzymy |
enzym | Typ reakce | Inhibitory | Aktivátory | Produkty / koenzymy |
|
|---|---|---|---|---|---|---|---|
| 1 | Oxaloacetát | Acetyl-CoA, voda | Citrát syntáza | kondenzace | Citrát, NADH, sukcinyl-CoA, ATP | Citrát | |
| 2a | Citrát | - | Akonitáza | Dehydratace | cis akonitát, voda | ||
| 2 B | cis akonitát | voda | Hydratace | Isocitrate | |||
| 3a | Isocitrate | NAD + | Isocitrát dehydrogenáza | oxidace | NADH, ATP | Ca 2+ , ADP | Kyselina šťavelová, NADH |
| 3b | Kyselina šťavelová | H + | Dekarboxylace | α-ketoglutarát, CO 2 | |||
| 4. místo | α-ketoglutarát | NAD + , CoA-SH | komplex α-ketoglutarát dehydrogenázy | Oxidační dekarboxylace | NADH, sukcinyl-CoA | Ca 2+ | Sukcinyl-CoA, NADH, CO 2 |
| 5 | Succinyl-CoA | GDP, fosfát | Sukcinyl-CoA syntetáza | Přenos fosfátů | Succinate, GTP, CoA-SH | ||
| 6. | Succinate | FAD | Sukcinát dehydrogenáza | oxidace | Malonate | Mg 2+ | Fumarát, FADH 2 |
| 7. | Fumarát | voda | Fumaráza | Hydratace | L-malát | ||
| 8. | L -Malat | NAD + | Malát dehydrogenáza | oxidace | Oxaloacetát, NADH | ||
| Není součástí cyklu kyseliny citrónové: | |||||||
| A. | Pyruvát | NAD + , CoA-SH | Komplex pyruvátdehydrogenázy | Oxidační dekarboxylace | NADH, acetyl-CoA | Ca 2+ | Acetyl-CoA |
| B. | Pyruvát | ATP, H + , CO 2 | Pyruvátkarboxyláza | Karboxylace | Acetyl-CoA | Oxaloacetát, ADP, fosfát | |
nařízení
Cyklus kyseliny citronové jakožto centrální bod aerobního metabolismu podléhá silným regulačním vlivům. Kromě inhibice produktu („negativní zpětná vazba“, kompetitivní inhibice ) a inhibice jinými meziprodukty , zejména NAD + / NADH, hrají jako efektory hlavní roli ADP / ATP a Ca 2+ . Regulační kontrole podléhají zejména dílčí kroky hlavní exergonie : syntéza citrátu 1 (ΔG o = −38 kJ / mol), tvorba ketoglutarátu 3 (ΔG o = −7 kJ / mol) a tvorba sukcinyl-CoA 4 (ΔG o = -37 kJ / mol).
Výše uvedené exergonické dílčí kroky jsou inhibovány vysokými hladinami NADH. Například pokud se dýchací řetězec zastaví kvůli nedostatku kyslíku, pokud se spotřebuje méně NADH a jeho koncentrace se zvýší, cyklus kyseliny citronové se může také zastavit.
Pokud je naopak zapotřebí málo energie (např. Svaly v klidu), koncentrace ATP se zvyšuje s poklesem koncentrace ADP. Zatímco ADP je alosterický aktivátor isocitrát dehydrogenázy, ATP inhibuje jeho účinek: cyklus se zpomaluje.
Další efektory cyklu kyseliny citronové naleznete v tabulce.
Inhibitory
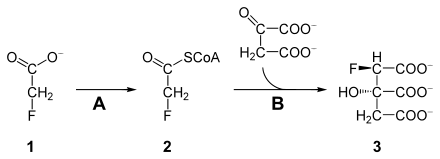
Fluoracetát je toxický, protože může blokovat cyklus kyseliny citronové. Fluoracetát ( 1 ) je nejprve metabolizován acetyl-CoA syntetázou ( A , EC 6.2.1.1 ) na fluoracetyl-CoA ( 2 ). Fluoracetyl-CoA, stejně jako jeho analog acetyl-CoA, je katalyzován citrátsyntázou ( B ) a kondenzován s oxaloacetátem. Produkt, ( 2R , 3S ) -fluorocitrát ( 3 ), nemůže být zpracován akonitázou a blokuje ji, čímž se v tomto bodě odlomí cyklus kyseliny citronové. Buňka je odpojena od dodávky energie a zemře (smrtící syntéza).
Cyklus kyseliny citronové u lidí
U lidí, i, cukry jsou rozděleny na CO 2 a H 2 O přes glykolýza , oxidativní dekarboxylace pyruvátu a kyseliny citronové cyklus s tvorbou energetických nosičů NADH + H + , FADH 2 , GTP a ATP . Energie vytvořených nosičů energie (kromě ATP) se přenáší dýchacím řetězcem na ADP , který se pak může pomocí fosfátového zbytku zabudovat do dalšího ATP . Zde NADH + H + uvolňuje přibližně energii, kterou lze použít k vytvoření 3 ATP, FADH 2 uvolňuje přibližně energii, která je potřebná k vytvoření 2 ATP, GTP poskytuje energii pro tvorbu molekuly ATP ADP a fosfátu.
Při zvýšené poptávce po výkonu v důsledku nedostatku kyslíku, bez kterého dýchací řetězec nemůže běžet, se rostoucí procento pyruvátu získaného při glykolýze již aerobně nepřeměňuje na acetyl-CoA, ale anaerobně při konzumaci jednoho NADH + H + na molekulu pyruvátu na L - laktát , anion kyseliny mléčné. Zdá se nepochopitelné, že NADH + H + je spotřebováván, protože tělo v této situaci skutečně potřebuje energii. Při bližším zkoumání je však tento krok nezbytný a energizující, protože NADH + H + nelze dýchacím řetězcem stejně přeměnit na ATP (nedostatek kyslíku). 2 ATP, které mohou být použity přímo svaly bez dýchacího řetězce, však mohou vznikat při glykolýze rozložením 1 molekuly glukózy na 2 molekuly pyruvátu. To také vytváří 2 molekuly NADH + H + , takže na konci je energetický zisk 2 ATP. Aby však tvorba pyruvátu pokračovala stabilně, je třeba zajistit, aby byl pyruvát ze systému odstraňován znovu a znovu (aby koncentrace příliš nestoupala), k čemuž by normálně došlo dekarboxylací a cyklem kyseliny citronové. Protože to není možné kvůli nedostatku kyslíku, jak je uvedeno, pyruvát se rozkládá na laktát. Takže glykolýza může pokračovat a vytvoří se alespoň 2 ATP:
| Metabolický proces | Energetická bilance |
|---|---|
| Konverze 2 pyruvátů na 2 laktáty | −6 ATP (2 NADH + H + ) |
| Rozklad 1 glukózy na 2 pyruvát | +8 ATP (2 NADH + H + a 2 ATP) |
| Rovnováha na molekulu glukózy | +2 ATP |
Kyselina mléčná musí být rozložena nad určitou koncentraci, protože má účinek snižující výkon snížením hodnoty pH . Svaly uvolňují laktát do krve, která je poté transportována do jater. Laktát se poté v játrech přeměňuje na glukózu procesem glukoneogeneze . Zde je zapotřebí více energie, než kolik absorboval sval. Proces přeměny pyruvátu na laktát je proto při regionálním pohledu na sval jen z krátkodobého hlediska prospěšný z hlediska energie. Pro organismus jako celek to však znamená dlouhodobé energetické ztráty (viz také Coriho cyklus ). To ukazuje, že v extrémních situacích - zde s vysokými požadavky na výkon - může být tělo připraveno dlouhodobě propadat energii, aby v krátké době dosáhlo požadovaného výkonu.
Glukóza vytvořená v játrech pak může být reabsorbována svalovými buňkami krví. Tento cyklus je také známý jako Coriho cyklus . Schopnost udržovat vysoký výkon i přes vysoké hladiny laktátu se ve fyziologicky založené tréninkové teorii označuje jako tolerance laktátu .
→ viz také: glykolýza , fermentace kyselinou mléčnou
varianty
U bakterií jsou normou metabolické dráhy modifikovaného cyklu kyseliny citrónové, u kterých chybí dílčí krok (13 ze 17 zkoumaných). Chybějící krok může nebo nemusí být nahrazen jinými reakčními kroky. Ve skutečnosti jsou známy pouze dva typy bakterií, které mají aktivitu ketoglutarát dehydrogenázy (KDH): Bacillus japonicum a Escherichia coli . Bakterie Escherichia coli vede celý cyklus kyseliny citronové, jak je popsáno za aerobních podmínek. Za anaerobních podmínek je schopen deaktivovat KDH. Metabolické dráhy, které dříve tvořily kruh, jsou nyní spojeny jako strom. M. tuberculosis, na druhé straně, může přepínat mezi dvěma různými cykly kyseliny citronové, z nichž oba jsou odlišné od eukaryotické dráhy.
Archaea , ale také některé bakterie, jako je Helicobacter pylori , která roste za mikroaerofilních podmínek, katalyzují přeměnu α-ketoglutarátu na sukcinyl-CoA pomocí 2-ketoglutarátu citlivého na oxidaci: ferredoxin oxidoreduktázy (OGOR, EC 1.2.7.3 ) . Na rozdíl od OGDC obsahuje tento shluky železo-síra ; chybí flavin a amid kyseliny lipoové. Místo NADH se jako redukční ekvivalent používá ferredoxin . Také Mycobacterium tuberculosis obsahuje enzym závislý na CoA, který je však stabilní i za aerobních podmínek.
V různých mykobakterií (včetně Mycobacterium tuberculosis ), E1 podjednotka ketoglutarátdehydrogenáza nahrazena ketoglutarát dekarboxylázy, který nezávisle na koenzymu A, zpočátku vytváří jantarové semialdehyde, který je přeměněn z NADP + -dependentní sukcinát semialdehyd na sukcinát dehydrogenázy dehydrataci .
obrácení
U některých bakterií je cyklus kyseliny citronové provozován v opačném pořadí pro asimilaci oxidu uhličitého ( redukční cyklus kyseliny citronové ). Zde se při spotřebě ATP a použití redukčních látek obcházejí tři energeticky nepříznivé kroky cyklu oxidační kyseliny citrónové: Citrát syntáza je nahrazena ATP citrát lyázou, α-ketoglutarát dehydrogenáza α-ketoglutarát syntázou a sukcinát-dehydrogenáza fumarátreduktázou.
V roce 2018 výzkumné skupiny u dvou termofilních, sírou redukujících anaerobních bakterií ( Desulfurella acetivorans a Thermosulfidibacter takaii ) zjistily, že používají obrácené pořadí cyklu kyseliny citronové, ale nekódují gen pro ATP-závislou citrátovou lyázu požadovanou v cyklus reduktivní kyseliny citronové. Tato metabolická cesta se nazývala reverzní nebo reverzní oxidační cyklus kyseliny citronové („roTCA“), aby se odlišil redukční cyklus kyseliny citronové („rTCA“). Bakteriím se podaří zvrátit tvorbu citrátu účinnou metabolizací následných metabolitů malátu a acetyl-CoA; ve výsledku je koncentrace oxaloacetátu extrémně nízká, takže rovnováha štěpení citrátem je posunuta na stranu oxaloacetátu. Uložením jedné molekuly ATP je v roTCA vyžadována pouze jedna molekula ATP k fixaci dvou molekul CO 2 . To odpovídá energetickým požadavkům na cestu reduktivní acetyl-CoA .
Viz také
- Buněčné dýchání
- Glyoxylátový cyklus
- Biochemické cykly
- Metabolismus glukózy
- Redukční cyklus kyseliny citronové
literatura
- Reginald Garrett, Charles M. Grisham: Biochemistry . International Student Edition. 4. vydání. Cengage Learning Service, Australia 2009, ISBN 0-495-11464-2 , str. 563n.
- Geoffrey Zubay: biochemie. 4. vydání. Mcgraw-Hill International, London 1999, ISBN 3-89028-701-8 .
- Donald Voet, Judith G. Voet: Biochemistry . Wiley-VCH, Weinheim 1994, ISBN 3-527-29249-7 .
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemistry. 6. vydání. Spectrum, Heidelberg 2007, ISBN 3-8274-1800-3 .
- H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn, Carsten Biele (překlad): Biochemistry. 4. vydání. Pearson Studium, Mnichov 2008, ISBN 3-8273-7312-3 .
- David L. Nelson, Michael M. Cox, Albert L. Lehninger (první): Lehninger Biochemie. 4. vydání. Springer, Berlin 2009, ISBN 3-540-68637-1 .
webové odkazy
- Co je cílem citrátového cyklu? ( Memento ze dne 2. května 2016 v internetovém archivu )
Individuální důkazy
- ^ Nobelova cena za medicínu 1953 .
- ^ HA Krebs a WA Johnson: Úloha kyseliny citronové v intermediárním metabolismu ve zvířecích tkáních. In: Enzymologia. Svazek 4, 1937, str. 148-156 (Dotisk: HA Krebs, WA Johnson: Úloha kyseliny citronové v intermediárním metabolismu ve zvířecích tkáních . In: FEBS dopisy . 117 Suppl, 25. srpna 1980, str. K1-10 , PMID 6998725 . )
- ^ Albert L. Lehninger, David L. Nelson, Michael M. Cox: Lehninger Biochemie. 3. Vydání. Springer, Berlin 2009, ISBN 3-540-41813-X , s. 626.
- ^ Hans Günther Schlegel, Georg Fuchs (ed.): Obecná mikrobiologie. 8. vydání. Thieme, Stuttgart 2006, ISBN 3-13-444608-1 , s. 326.
- ^ Reginald Garrett, Charles M. Grisham: Biochemie. International Student Edition. 4. vydání. Cengage Learning Services, Austrálie 2009, ISBN 0-495-11464-2 , s. 573.
- ↑ Marc W. van der Kamp, John D. McGeagh, Adrian J. Mulholland: „Smrtelná syntéza“ fluorocitrátu citrát syntázou vysvětlena pomocí QM / MM modelování . In: Angewandte Chemie International Edition . páska 50 , č. 44 , 24. října 2011, ISSN 1521-3773 , s. 10349-10351 , doi : 10,1002 / anie.201103260 .
- ↑ SJ Cordwell: Mikrobiální genomy a „chybějící“ enzymy: předefinování biochemických drah . In: Archiv mikrobiologie . páska 172 , č. 5 , 1. října 1999, s. 269-279 , doi : 10,1007 / s002030050780 , PMID 10550468 .
- ↑ X. května, MW Adams: Charakterizace čtvrtého typu enzymu oxidujícího 2-keto kyselinu z hypertermofilního archaonu: 2-ketoglutarát ferredoxin oxidoreduktáza z Thermococcus litoralis . In: Journal of Bacteriology . páska 178 , č. 20. října 1996, s. 5890-5896 , PMID 8830683 , PMC 178443 (plný text).
- ^ SM Pitson, GL Mendz, S. Srinivasan, SL Hazell: Cyklus trikarboxylové kyseliny Helicobacter pylori . In: European Journal of Biochemistry / FEBS . páska 260 , č. 1 , únor 1999, s. 258-267 , PMID 10091606 .
- ^ Anthony D. Baughn, Scott J. Garforth, Catherine Vilchèze, William R. Jacobs: Anaerobní alfa-ketoglutarát ferredoxin oxidoreduktáza završuje cyklus oxidační trikarboxylové kyseliny Mycobacterium tuberculosis . In: PLoS patogeny . páska 5 , č. 11. listopadu 2009, s. e1000662 , doi : 10,1371 / journal.ppat.1000662 , PMID 19936047 .
- ^ Jing Tian, Ruslana Bryk, Manabu Itoh, Makoto Suematsu, Carl Nathan: Varianta cyklu trikarboxylové kyseliny u Mycobacterium tuberculosis: identifikace alfa-ketoglutarát dekarboxylázy . In: Sborník Národní akademie věd . páska 102 , č. 30 , 26. července 2005, s. 10670-10675 , doi : 10,1073 / pnas.0501605102 , PMID 16027371 .
- ↑ Achim Mall et al.: Reverzibilita citrát syntázy umožňuje autotrofní růst termofilní bakterie . In: Věda (New York, NY) . páska 359 , č. 6375 , 2. února 2018, s. 563-567 , doi : 10,1126 / science.aao2410 , PMID 29420287 .
- ↑ Takuro Nunoura et al.: Prvotní a reverzibilní cyklus TCA ve fakultativně chemolithoautotrofním termofilu . In: Věda (New York, NY) . páska 359 , č. 6375 , 2. února 2018, s. 559-563 , doi : 10,1126 / science.aao3407 , PMID 29420286 .
- ↑ Stephen W. Ragsdale: Stealth reakce způsobující fixaci uhlíku . In: Věda (New York, NY) . páska 359 , č. 6375 , 2. února 2018, s. 517-518 , doi : 10,1126 / science.aar6329 , PMID 29420277 .