Acetylcholinesteráza
| Acetylcholinesteráza | ||
|---|---|---|

| ||
| Ribbonový model lidského monomeru AChE v komplexu s fascikulinem (hadí toxin ), podle PDB 1B41 | ||
|
Stávající strukturální data : 1b41 , 1f8u , 1vzj , 1PUV , 1PUW , 2CLJ , 2X8B , 3LII 4BDT , 4EY4 , 4EY5 , 4EY6 , 4EY7 , 4EY8 , 4M0E , 4M0F , 4PQE | ||
| Vlastnosti lidského proteinu | ||
| Hmotnost / délka primární struktury | 58,4 až 67,4 kilodaltonů / 526 až 617 aminokyselin (v závislosti na izoformě) | |
| Sekundární až kvartérní struktura | Homotetramer | |
| Izoformy | 4. místo | |
| Identifikátor | ||
| Genová jména | AChE ; ARAChE; N-AChE; YT | |
| Externí ID | ||
| Klasifikace enzymů | ||
| ES, kategorie | 3.1.1.7 , esteráza | |
| Typ odpovědi | hydrolýza | |
| Podklad | Acetylcholin + H 2 O | |
| produkty | Cholin + acetát | |
| Výskyt | ||
| Homologická rodina | Karboxylesteráza | |
| Rodičovský taxon | Strunatci | |
| Ortolog | ||
| člověk | Dům myš | |
| Entrez | 43 | 11423 |
| Soubor | ENSG00000087085 | ENSMUSG00000023328 |
| UniProt | P22303 | P21836 |
| Refseq (mRNA) | NM_000665 | NM_001290010 |
| Refseq (protein) | NP_000656 | NP_001276939 |
| Genový lokus | Chr 7: 100,89 - 100,9 Mb | Chr 5: 137,29 - 137,29 Mb |
| PubMed vyhledávání | 43 |
11423
|
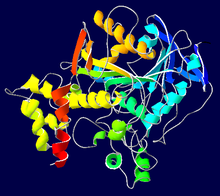
Acetylcholinesterázy ( AChE ) je enzym ze skupiny cholinesteráz , které specificky neurotransmiter acetylcholin (ACh) v kyselině octové a cholinu hydrolyzovaných .
účinek
AChE působí primárně v centrálním nervovém systému (CNS), na neuromuskulárních synapsích (jako je motorická koncová deska ) a v autonomním nervovém systému , protože ACh se zde používá jako neurotransmiter pro exocytózu . Acetylcholinesteráza je jedním z nejrychlejších enzymů vůbec (řízené difúzí, viz kinetika enzymů a difúze ). Vysoká rychlost je nezbytná, aby byl časový interval mezi excitacemi přenášenými neurony co nejkratší okamžitým rozpadem neurotransmiteru.
Struktura aktivního centra enzymu
Aktivním centrem je umístěn v 20 angstromů (2 nanometr) hluboké kapsy v enzymu (také známý jako rokle ) a skládá se z katalytické triády (součást esteratic místě ES), který se skládá z aminokyselin serin , histidin a kyselinu glutamovou , na kterém je acetylcholin štěpen, a na opačné straně (ve vzdálenosti o něco více než 4 Angstromy (0,4 nm)) aniontové místo (AS), na které se váže atom dusíku acetylcholinu. V blízkosti ES jsou další vazebná místa, například kapsa pro acylovou skupinu acetylcholinu. Názvy pocházejí z doby před stanovením přesné trojrozměrné struktury enzymu: ES (esteratické místo) s aktivním středem, aniontové místo AS (aniontové místo) a mimo hlubokou kapsu na vnějším okraji periferního aniontového místa ( PAS), je důležitý pro vazbu řady AChE inhibitorů (jako je například hadí jed fascikulin ) a pro alosterickou modulaci funkce enzymu.
Inhibitory cholinesterázy
Inhibitory cholinesterázy zvyšují koncentraci acetylcholinu jak na motorické endplate svalových buněk, tak v parasympatickém nervovém systému . Jeho použití je v medicíně velmi rozšířené.
- Neostigmin se často podává na konci anestézie, aby se zabránilo účinkům svalových relaxancií . Za tímto účelem je kombinován s atropinem, aby měl pouze cílený účinek na svalové buňky.
- Dlouhodobě působící pyridostigmin se používá ve formě běžné soli pyridostigminiumbromidu jiné než CNS pro myasthenia gravis .
- Na rozdíl od neostigminu je fyzostigmin běžný v centrálním nervovém systému a používá se k léčbě centrálního anticholinergního syndromu .
- Donepezil , rivastigmin , takrin a galantamin , které jsou schváleny pro symptomatickou léčbu Alzheimerovy choroby , jsou inhibitory cholinesterázy.
Podle švédské studie mají donepezil, rivastigmin a galantamin také kardioprotektivní účinky. U pacientů, kteří užívali tyto léky na Alzheimerovu chorobu, byla o třetinu nižší pravděpodobnost infarktu . Úmrtnost byla také nižší v této skupině. Některé složky Harpagophytum procumbens (ďáblův dráp) mohou navíc inhibovat cholinesterázy, včetně acetylcholinesterázy.
Další aplikací inhibitorů cholinesterázy jsou insekticidy , jako např
a bojové chemické látky jako
- Sarin , Tabun , Soman , VX a Novitschok .
Acetylcholinesterázy je inhibována , mimo jiné tím, že organofosforových kyselých esterů prostřednictvím fosforylace z serinu . Enzym se stává neúčinným, tj. Již nemůže hydrolyzovat ACh a ACh se akumuluje ve vyšších koncentracích v synaptické štěrbině . Zvýšení parasympatického tónu vede k motorické a citlivé nadměrné stimulaci vnitřních orgánů, zejména ke křečím zažívacího traktu, a může vést k úmrtí na paralýzu dýchacích cest . Různé karbamáty používané jako insekticidy mají analogický účinek , přenášejí svou karbamátovou skupinu na serin a tím deaktivují enzym. Dalšími inhibitory AChE jsou např. B. diisopropylfluorophosphate (DIFP), 4-chloromercuribenzoic kyselina a Huperzine .
Řada nervových látek typu esteru s organickou kyselinou fosforečnou, jako je sarin , VX a Novitschok, působí jako zvláště účinné inhibitory AChE, ve kterých molekuly zapadají do hluboké kapsy enzymu napodobováním vazby acetylcholinu na samotné ES a AS. Aminoskupina VX a Novitschok se váže na AS, skupina esteru kyseliny fosforečné na ES. Bojové látky fosforylují serin v aktivním centru a tvoří s ním kovalentní vazbu. Způsobem specifickým pro příslušnou nervovou látku následuje proces zvaný stárnutí , který začíná víceméně rychle a vede k nevratné ztrátě funkce enzymu. Komplex s konformačními změnami, který se tvoří během stárnutí dealkylací na skupině fosforu, je poté rezistentní vůči spontánní hydrolýze a silným nukleofilům ( oximům ) podávaným jako protijed .
Jiná použití
Acetylcholinesteráza se také používá v zařízeních pro kontrolu pitné vody nebo pro zkoumání vzorků na insekticidy nebo jiné toxiny inhibující acetylcholinesterázu.
Viz také
literatura
- Hay Dvir, Israel Silman, Michal Harel, Terrone Rosenberry, Joel Sussman: Acetylcholinesteráza: Od 3D struktury k funkci . In: Chem. Biol. Interact. , Svazek 187, 2010, str. 10-22, PMC 2894301 (plný text)
webové odkazy
- Acetylcholinesteráza . Proteopedia; s manipulovatelnými 3D modely
Individuální důkazy
- ↑ Hay Dvir, Israel Silman, Michal Harel, Terrone Rosenberry, Joel Sussman: Acetylcholinesteráza: Od 3D struktury k funkci . In: Chem. Biol. Interact. , Svazek 187, 2010, s. 10-22, Obrázek 7,8, PMC 2894301 (volný plný text).
- ↑ Viz obrázek 2 ve Dvir et al.: Acetylcholinesteráza . In: Chem. Biol. Interact. , Svazek 187, 2010
- ↑ P. Nordstrom, D. Religa, A. Wimo, B. Winblad, M. Eriksdotter: Použití inhibitorů cholinesterázy a riziko infarktu myokardu a úmrtí: celostátní kohortní studie u pacientů s Alzheimerovou chorobou. In: European Heart Journal . 34, 2013, s. 2585-2591. doi: 10,1093 / eurheartj / eht182
- ^ MI Georgiev, K. Alipieva, IE Orhan: Cholinesterázové inhibiční a antioxidační aktivity Harpagophytum procumbens ze systémů in vitro . In: Phytother. Res. Únor 2012, s. 313-316 , doi : 10,1002 / ptr.3555 , PMID 21721061 .
- ^ Horst Thiermann, Nadine Aurbek, Franz Worek: Léčba otravy nervovými agenty . In: Franz Worek, John Jenner, Horst Thiermann (eds.): Chemical Warfare Toxicology . Royal Society of Chemistry, svazek 2, 2016, s. 4
