Puriny
V chemii se puriny tvoří skupinu z organických sloučenin , které patří k heterocyklů (přesněji: heteroaromatické sloučeniny ). Jsou odvozeny od mateřské sloučeniny purinu .
Kromě pyrimidinů jsou puriny důležitými stavebními kameny nukleových kyselin . Nejsou nezbytné , ale jsou formovány samotným lidským tělem. Potraviny živočišného původu obsahují mnoho purinů kvůli jejich vysokým koncentracím v kůži a drobech. Po konzumaci se puriny u lidí štěpí na kyselinu močovou a vylučují se ledvinami ; U různých jiných druhů zvířat dochází k další degradaci (například na alantoin u skotu ). Proto je název odvozen z latiny purus = čistý a acidum uricum = kyselina močová, protože se jedná o „čistou“ základní strukturu kyseliny močové, kterou poprvé syntetizoval v roce 1898 Emil Fischer .
Přehled
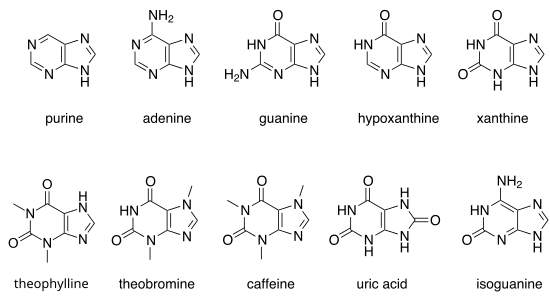
Pokud jsou atomy vodíku v pozicích 2, 6 a 8 nahrazeny jinými radikály, vzniknou různé substituované puriny:
| Příjmení | Základní struktura | R 6 | R 2 | R 8 |
|---|---|---|---|---|
| Purin |  |
-H | -H | -H |
| Adenin | -NH 2 | -H | -H | |
| Guanine | -ACH | -NH 2 | -H | |
| kyselina močová | -ACH | -ACH | -ACH | |
| Hypoxanthin | -ACH | -H | -H | |
| 6-purinthiol | –SH | -H | -H | |
| 6-thioguanin | –SH | -NH 2 | -H | |
| Xanthin | -ACH | -ACH | -H | |
| Isoguanin | -NH 2 | -ACH | -H |
Všechny puriny, které se vyskytují jako normální stavební kameny v DNA a RNA , tj. Adenin ( 2 ) a guanin ( 3 ), se označují jako purinové báze . Po úpravě se může stát, že hypoxanthin a xanthin jsou také dočasně součástí RNA nebo DNA, ale jsou znovu nahrazeny opravnými enzymy. 7-methylguanin je součástí struktury víčka .
Dalšími důležitými puriny jsou hypoxantin , xanthin , teofylin , teobromin , kofein , kyselina močová a isoguanin .
Tautomerismus
Vzhledem k molekulárním segmentům se základním vzorem N = C - X - H (s X = O, S nebo NH) existuje možnost tautomerismu (viz laktam-laktim , thiolaktam-thiolaktim a iminenaminový tautomerismus ):
Biologický význam
- Pokud jsou adenin a guanin spojeny v poloze 9 s atomem C-1 ribózy (v DNA s deoxyribózou ), vzniknou nukleosidy adenosin a guanosin . Esterifikace ribosy s fosfátem vytváří nukleotidy , které jsou stavebními kameny mnoha fyziologicky významných molekul. (Viz také: Riboflavin a AMP , ADP , ATP , RNA , DNA , cAMP , NADPH , NADH , FAD , koenzym A , sukcinyl-koenzym A. )
- Kyselina dusitá (HNO 2 ) převádí aminoskupinu na hydroxylovou skupinu . Tím se vytvoří hypoxanthin z adeninu a xanthin z guaninu . Působení kyseliny dusité na DNA (jako mutagen) provádí tuto změnu při multiplikaci DNA () reduplikaci ) na chybné párování bází, a tedy na modifikovanou sekvenci bází dochází k modifikovaným proteinům, a proto může dojít ke změněnému fenotypu .
- TRNA také obsahuje neobvyklé purinových bází (dlouhé základny): od A + je vytvořen přidáním protonu v poloze 7, což znamená, že atom dusíku v tomto bodě je kladně nabitou. Dusík kruhového systému může být methylován, takže jsou také kladně nabité. Příklady: 1-methyladenin (m 1 A), 7-methyladenin (m 7 A), 7-methylguanin (m 7 G). V případě 2'-O-methylguanosinu (m 2 ' G) je C-2 atom ribózy methylován. Odpovídající báze jsou upraveny až po transkripci a ovlivňují přesnost translace i aktivitu a stabilitu tRNA (viz také nukleosidy ).
- trans- -zeatin (N 6 - (Δ 2 ' isopentenyl) -aminopurine) je přirozeně se vyskytující cytokinin .
- Kyseliny močové je produkt rozpadu metabolismu purinů.
metabolismus
Purinové nukleotidy AMP, ADP, ATP, GTP, GDP a GMP jsou odvozeny od purinového heterocyklu, jehož běžným prekurzorem v biosyntéze je inosinmonofosfát (IMP). Mnoho dalších látek slouží jako meziprodukty a tvoří síť, ve které může být každý z nukleotidů vyroben z jednoho z meziproduktů, syntetizován od nuly ( de-novo ) nebo rozdělen na kyselinu močovou (viz obrázek).
De novo biosyntéza IMP
Puriny nejsou v organismu syntetizovány jako volné molekuly , ale vždy jako nukleotidy . Výchozí molekulou je α- D - ribóza -5-fosfát, meziprodukt cyklu pentózo-fosfátu . Poté se krok za krokem vytvoří základní struktura purinu, přičemž jednotlivé složky dodávají různé molekuly. Konečným produktem tohoto syntetického řetězce je inosinmonofosfát (IMP), nukleotid hypoxantinu, který se v dalších krocích převádí na nukleotidy adenosinu nebo guanosinu.
Interkonverze AMP a IMP
Biosyntéza AMP (de novo)
Syntéza AMP začíná syntézou IMP a vyžaduje u všech živých bytostí dva kroky:
IMP a aspartát se ligují za použití GTP, katalyzovaného adenylosukcinát syntázou . Adenylosukcinát lyáza se používá k odštěpení fumarátu z meziproduktu, což vede k AMP.
IMP od AMP
Enzym AMP deaminázy usnadňuje přeměnu AMP na IMP. To umožňuje eukaryotům získat IMP z purinových bází záchrannou cestou.
AMP se převádí na IMP; Voda se spotřebovává, vyrábí se amoniak .
Interkonverze GMP / XMP a IMP
GMP biosyntéza (de novo)
Stejně jako u syntézy ATP se GMP získává z IMP ve dvou krocích. První krok, oxidace IMP a XMP, je katalyzován IMP dehydrogenázou .
IMP se oxiduje na XMP. Druhý krok se provádí pomocí GMP syntázy .
 +
+  + ATP + H 2 O + + AMP + PP i
+ ATP + H 2 O + + AMP + PP i 
![]()
GMP, AMP a kyselina glutamová se tvoří z XMP, ATP a glutaminu.
IMP od GMP
Zpětná reakce IMP z GMP v jednom kroku je možná za použití GMP reduktázy . To přispívá k rovnováze AMP / GMP v buňce.
Amoniak se oddělí od GMP a vytvoří se IMP. Reakce je nevratná.
Recyklace základen (sběrná cesta)
Když se RNA rozloží, kromě mononukleotidů se vytvoří volné báze a nukleosidy . Mononukleotidy lze získat tak, že purinové báze s fosforylovanou ribózou a nukleosidy kinázami znovu získají svou fosfátovou skupinu.
Demontáž
Fosfát se oddělí od nukleotidů (pomocí enzymu nukleotidázy ) a báze se poté odštěpí od výsledných nukleosidů katalyzovaných purinovou nukleosidázou . Guanin se deaminuje na xanthin pomocí guanin deaminázy . Xanthin se oxiduje na kyselinu močovou. U suchozemských plazů , ptáků , mnoha druhů hmyzu a primátů je to konečný produkt, který se vylučuje močí . Jiná zvířata a rostliny používají kyselinu močovou k tvorbě alantoinu , močoviny nebo amoniaku , který se v případě potřeby dusíku reabsorbuje jako amonium .
Receptory
Puriny se vážou na specifické receptory v buněčné membráně , takzvané purinergní receptory . Existují ionotropní a metabotropní purinergní receptory. Fyziologickým agonistou těchto receptorů je ATP .
Lékařský význam
Nemoci
V závislosti na místě narušení metabolismu purinů existují různé klinické obrazy:
- Lesch-Nyhanův syndrom je způsoben nedostatkem enzymu ( hypoxanthin-guanin-fosforibosyl-transferázu , HGPRT) v rámci recyklace bází (resyntézy). Výsledkem je, že se hromadí substráty 5-P-ribosyl-PP a puriny hypoxanthin a guanin, což také vede k akumulaci kyseliny močové. To způsobuje dnu , mentální retardaci a problémy s chováním.
- Dna je důsledkem hyperurikémie , zvýšené koncentrace kyseliny močové v krvi (387 µmol / l). Pod touto koncentrací je v krvi k dispozici dostatek bílkovin pro transport kyseliny močové, která je ve vodě málo rozpustná, a pro zabránění jejího srážení . Pokud je hladina kyseliny močové příliš vysoká, tento ochranný systém již není dostatečný a tvoří se usazeniny v kloubech , obalech šlach a dřeni ledvin .
- SCID (těžká kombinovaná imunodeficience) je způsobena 50násobným zvýšením koncentrace dATP. To narušuje křehkou rovnováhu v koncentraci stavebních bloků DNA a narušuje syntézu DNA, která primárně ovlivňuje buňky imunitního systému (T a B buňky).
- Nedostatek adenylosukcinázy , vzácné dědičné onemocnění, které může vést k mentálnímu postižení a v dětství je často smrtelné. Dotčeným enzymem je adenylosukcinát lyáza .
Léčivé látky
Purinové deriváty a analogy purinu hrají roli antimetabolitů : Azathioprin potlačuje imunitní systém , 8-azaguanin, 6-purinthiol a 6-thioguanin se používají proti určitým formám rakoviny a alopurinol proti dně. N -hydroxy-purin a purin- N -oxidy jsou karcinogenní (karcinogenní).
literatura
- Gerhard Heidelmann: Historie a definice poruch metabolismu purinů. In: Gerhard Heidelmann, Peter Thiele (ed.): Dnový syndrom. Artritida, nefropatie, nefrolitiáza kyseliny močové, diabetes mellitus, hyperlipoproteinémie, obezita, hypertenze, infarkt myokardu, okluze tepen. Drážďany 1974, s. 1-5.
Individuální důkazy
- ↑ CR Hancock, JJ Brault, RL Terjung: Ochrana stavu buněčné energie během kontrakcí: role AMP deaminázy. In: Journal of fyziologie a farmakologie: oficiální časopis Polské fyziologické společnosti. Svazek 57 Suppl 10, listopad 2006, str. 17-29 , PMID 17242488 . (Posouzení).
- ↑ HN Jayaram, DA Cooney a kol.: Důsledky inhibice IMP dehydrogenázy a její vztah k rakovině a apoptóze. In: Současná léčivá chemie. Svazek 6, číslo 7, červenec 1999, str. 561-574, PMID 10390601 . (Posouzení).
- ^ AK Werner, CP Witte: Biochemie mobilizace dusíku: katabolismus purinových kruhů. In: Trendy ve vědě o rostlinách. Svazek 16, číslo 7, červenec 2011, str. 381-387, doi : 10,1016 / j . Rostliny 2011.03.012 . PMID 21482173 . (Posouzení).
- ↑ BB Fredholm: Adenosinové receptory jako cíle drog. In: Experimental Cell Research . Svazek 316, číslo 8, květen 2010, str. 1284-1288, doi : 10,1016 / j.yexcr.2010.02.004 . PMID 20153317 . PMC 2866745 (plný text). (Posouzení).
- ↑ RJ Torres, JG Puig: Nedostatek hypoxantin-guanin fosforo-fosibyl-transferázy (HPRT): Lesch-Nyhanův syndrom. In: Orphanet Journal of Rare Diseases. Svazek 2, 2007, s. 48, doi : 10,1186 / 1750-1172-2-48 . PMID 18067674 . PMC 2234399 (plný text). (Posouzení).
- ↑ EB Gonzalez: Aktualizace patologie a klinické léčby dnavé artritidy. In: Klinická revmatologie. Svazek 31, číslo 1, leden 2012, str. 13-21, doi : 10,1007 / s10067-011-1877-0 . PMID 22069122 . PMC 3249158 (plný text). (Posouzení).
- ^ PL Riches, AF Wright, SH Ralston: Nedávné poznatky o patogenezi hyperurikémie a dny. In: Human Molecular Genetics . Svazek 18, R2 říjen 2009, str. R177-R184, doi : 10,1093 / hmg / ddp369 . PMID 19808794 . (Posouzení).
- ↑ J. Chinen, WT Shearer: Pokroky v základní a klinické imunologii v roce 2010. In: Journal of Allergy and Clinical Immunology . Svazek 127, číslo 2, únor 2011, str. 336-341, doi : 10.1016 / j.jaci.2010.11.042 . PMID 21281863 . PMC 3057129 (volný plný text). (Posouzení).
- ^ EK Spiegel, RF Colman, D. Patterson: Nedostatek adenylosukcinát lyázy. In: Molekulární genetika a metabolismus. Svazek 89, číslo 1-2, 2006 zář-říjen, str. 19-31, doi : 10,1016 / j.ymgme.2006.04.018 . PMID 16839792 . (Posouzení).
- ^ M. Samsel, K. Dzierzbicka: Terapeutický potenciál analogů a konjugátů adenosinu. In: Pharmacological Reports Volume 63, Number 3, 2011, str. 601-617, PMID 21857072 . (Posouzení).
- ^ T. Robak, E. Lech-Maranda a kol.: Analogy purinových nukleosidů jako imunosupresivní a antineoplastické látky: mechanismus účinku a klinická aktivita. In: Current Medicinal Chemistry . Svazek 13, číslo 26, 2006, str. 3165-3189, PMID 17168705 .
webové odkazy
- MedizInfo.de Potravinové stoly pro puriny a kyselinu močovou
- PurinTabelle.de Potravinové stoly pro puriny a kyselinu močovou
- C. Müller: Dna - nízko purinové jídlo proti bolesti. od: UGB-Forum 2/2000, str. 68-71, UGB-Verband, 2000