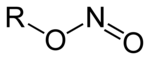Dusitany
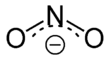
Dusitany jsou soli (M + NO 2 - , M: monovalentní kation ) a estery (R - O - N = O, R: organický zbytek) kyseliny dusité HNO 2 . Izomerní nitrosloučeniny (R-NO 2 ), ve kterých je organický zbytek přímo vázán na dusík, je třeba odlišit od esterů kyseliny dusité .
Příklady
|
|
||||||||||||||||||||||||||||
struktura
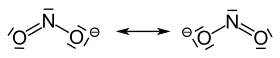
Dusitanový iont má šikmou strukturu s úhlem vazby 115 °. Obrázek ukazuje dvě mezomerní okrajové struktury :
Výskyt
Dusitanové ionty jsou vytvořeny chemickou reakcí nitrózní plyny s kyslíkem a vlhkostí vzduchu (viz kyselý déšť ), stejně jako v půdě v orgánech vody a v čistírnách odpadních vod podle dusitany bakterií ( Nitrosomonas ) od oxidací z amonných iontů se spotřebou kyslíku. V procesu degradace bílkovin jsou meziproduktem při úplné oxidaci amoniaku na dusičnan ( nitrifikace ). Vznikají také za anaerobních podmínek bakteriální redukcí z dusičnanových iontů ( nitrát reduktázy ).
Vysoký obsah dusitanů ve vodě naznačuje, že voda je silně znečištěna sloučeninami dusíku.
V průmyslu může úprava kovových povrchů, galvanické procesy a čištění výfukových plynů obsahujících oxidy dusíku vytvářet toxické odpadní vody z dusitanů, které je třeba před likvidací vyčistit.
použití
Dusitany ve formě draslíku (E 249) a dusitanu sodného (E 250) lze použít jako potravinářské přídatné látky jako stabilizátory barev v soli vytvrzující dusitany . Dusitany se však také používají nelegálně, např. B. používá se k barvení tuňáka .
Při výrobě uzenin je používání dusitanů povinné, protože brání rozvoji vysoce nebezpečné bakterie botulismu Clostridium botulinum . Ve Švýcarsku takový požadavek není. Na vzduchu sušené masné výrobky, jako je parmská šunka nebo chorizo, dusitany nevyžadují.
Při vyšších teplotách mohou v potravinách vznikat nitrosaminy společně s proteinovými složkami , které jsou považovány za karcinogenní (karcinogenní). Z tohoto důvodu tvrzené masné výrobky nesmí být nikdy na grilu.
Toxicita
Dusitany jsou toxické . Dusitanové ionty reaguje s železnými atomů obsahujících železo enzymů v buněčné dýchání a v hemoglobinu . Ten je oxidován na methemoglobin dusitany (viz také methemoglobinemie ) , čímž se ztrácí schopnost transportovat kyslík. Dusitany se také podílejí na tvorbě karcinogenních nitrosaminů .
Dusitany jsou také toxické pro ryby a další vodní živočichy v koncentracích nad 0,1 mg / l, i když existuje silná závislost na hodnotě pH vody, protože žábrami se do těla může dostat pouze kyselina dusičná . LD 50 (akutní toxicita) pro kyseliny dusité je asi 0,01 mg / l pro všechny druhy sladkovodních ryb. Dusitanové ionty nacházejí další cestu do ryby prostřednictvím aktivního transportního mechanismu, který ve skutečnosti slouží k absorpci chloridových iontů, pokud je jejich koncentrace ve vodě hluboko pod přibližně 15 mg / l. Dusitany jsou v mořské vodě mnohem méně toxické. Díky aktivnímu transportnímu mechanismu, vychytávání chloridových iontů, je toto aktivní vychytávání v soutěži s příjmem dusitanů. Při koncentraci chloridů 20 g / l a koncentraci dusitanu 1 mg / l připadá na jeden dusitanový iont 25 000 chloridových iontů. Ty vytlačují veškeré dusitany, takže dusitany jsou absorbovány ve výrazně menší míře.
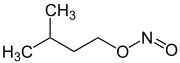
Organické dusitany působí v těle jako donoři oxidu dusnatého a mají tedy svůj účinek, které pomocí druhého poselského mechanismu uvolňují hladké svaly a způsobují vazodilataci . Při předávkování mohou také terapeuticky nepoužité dusitany vést k závažnému poklesu krevního tlaku , kardiovaskulárnímu kolapsu až po šok . Dusitany, jako je isobutylnitrit a amylnitrit, jsou vdechovány jako afrodiziaka pod názvem Poppers .
Čištění odpadních vod obsahujících dusitany
Jsou možné různé způsoby odstraňování dusitanů z odpadních vod před jejich vypouštěním do recipientu nebo kanalizace. Hlavní postupy jsou následující:
- Čištění odpadních vod oxidačními chemikáliemi. K tomu jsou vhodné chlornany a peroxidy . Při implementaci je důležitá hodnota pH. Za slabě kyselých podmínek je reakční rychlost vysoká a kvantitativně probíhá podle následujících rovnic:
nebo
V zásaditém rozmezí však reakce probíhají velmi pomalu, zatímco v silně kyselém rozmezí při pH <2,0 vznikají dusné plyny. Rovnice pro druhou reakci je následující:
Nevýhodou použití chlornanu k úpravě je to, že se voda solí chloridy a dusičnany. Kromě toho mohou organické halogenované sloučeniny ( AOX ) uhlovodíků (HC) vznikat, pokud voda obsahuje HC. Při použití peroxidů existuje riziko katalytického rozkladu kovy nebo kovovými solemi. To může způsobit neekonomickou spotřebu peroxidu.
- Dalším způsobem, jak odstranit dusitany, je rozbít je kyselinou sulfamovou nebo močovinou . Degradace, která vede ke snížení dusitanů, probíhá pro kyselinu sulfonovou podle rovnice:
a tedy pro močovinu:
Při použití kyseliny sulfamové je třeba počítat s tvorbou síranů a volných kyselin. Ten vyžaduje neutralizaci, aby se zvýšil obsah solí v vyčištěné odpadní vodě. Kromě toho mohou být za nepříznivých podmínek vytvářeny oxidy dusíku. K těmto nevýhodám nedochází při použití močoviny, pokud je zabráněno odplyňování dusičných plynů. Toho lze dosáhnout, pokud je degradace prováděna v uzavřeném reaktoru. Amoniak (NH 4 + ) lze současně rozdělit podle následující rovnice:
Použití močoviny je ekologicky výhodné, protože jako konečné produkty se vyrábějí pouze plyny dusík a oxid uhličitý a voda. Je zabráněno akumulaci soli v odpadních vodách.
důkaz
Dusitany lze detekovat pomocí barevné reakce. Za tímto účelem se vodný vzorek smíchá s trochou Lungeova činidla (kyselina, částečně stabilní roztok kyseliny sulfanilové a α-naftylaminu ) podle reakce Johanna Petera Grieße z roku 1858. Červenofialové zbarvení v důsledku vytvořeného azobarviva indikuje dusitany.
Tato reakce je dále rozvíjena fotometrickým měřením pro kvantitativní stanovení dusitanů z. B. používané ve vodě. Je standardizován v DIN EN 26 777 (do roku 1993: DIN 38 405 D10).
Viz také
webové odkazy
Individuální důkazy
- ↑ Dietmar Kunath: Dusitany. In: In: Claus Schaefer, Torsten Schröer (Hrsg.): Velký lexikon akvaristiky. Eugen Ulmer, Stuttgart 2004, ISBN 3-8001-7497-9 , s. 708.
- ^ Gerhard Gutekunst, Waldemar Mzyk. In: WLB Voda, vzduch a půda. 1-2, 1991, s. 39.
- ↑ Ministerstvo zdravotnictví kantonu Basilej-Stadt: Nelegální barvení masa z tuňáka. In: gd.bs.ch . 28. května 2019. Získáno 28. května 2019 .
- ↑ Dietmar Kunath: Dusitany. 2004.
- ↑ Armin Glaser: Poradce pro chemii mořské vody. 2008, Rüdiger Latka Verlag, ISBN 978-3-9810570-2-7 .
- ^ Gerhard Gutekunst, Waldemar Mzyk. In: WLB Voda, vzduch a půda. 1-2, 1991, s. 39-40.
- ^ Gerhard Gutekunst, Waldemar Mzyk. In: WLB Voda, vzduch a půda. 1-2, 1991, s. 40.