C 4 rostlina
| Pojmenovávací molekuly C 4 s modrým řetězcem čtyř atomů uhlíku |
| Kyselina L-asparagová |
| Kyselina L-jablečná |
Rostliny C 4 využívají metabolickou cestu k první předfixaci oxidu uhličitého pro fotosyntézu a teprve poté jej vybudují na sacharidy jako rostliny C 3 v Calvinově cyklu (C 4 fotosyntéza). Název C 4 je odvozen od prvního fixačního produktu, který vzniká asimilací oxidu uhličitého. Zatímco v C 3 rostliny se jedná o oxid sloučeniny s třemi atomy uhlíku, ( D -3 fosfoglycerát ) je první , co se nachází v C 4 rostliny je oxalacetát , sloučenina se čtyřmi atomy uhlíku.
Asimilace oxidu uhličitého a Calvin cyklu probíhají prostorově od sebe odděleny v C 4 rostlin. Aplikací energie se oxid uhličitý aktivně obohacuje, což vede k vyšší rychlosti fotosyntézy - zvláště při nedostatku vody a z toho vyplývajícím zúžení průduchů . Rostliny C 4 jsou proto za suchých podmínek ekofyziologicky lepší než rostliny C 3 . Díky aktivnímu obohacení probíhá fotorespirace mnohem méně často. Typickými rostlinami C4 jsou zejména trávy , včetně známých užitkových rostlin, jako je kukuřice , cukrová třtina a proso , ale také další druhy, jako je amarant .
Rostliny s metabolizmem kyseliny Crassulacean (rostliny CAM) postupují podobným způsobem jako rostliny C 4 , ale s nimi se před sebou dočasně oddělují prefixace a Calvinův cyklus.
Výskyt C 4 fotosyntézy v rostlinné říši

Asi 3% Bedecktsamer provozuje C 4 -Photosynthese. Většina (přibližně 80%) patří trávám , zejména trávám sladkým , následují ostřice . Většina rychle rostoucích zemědělských rostlin jsou rostliny C 4 , ale do této kategorie spadá také mnoho plevelů klasifikovaných jako velmi tvrdohlavé (např. Barnacle proso , náprstník krvavý nebo ostřice hlíznatá ). Tato metabolická cesta se však nachází také v řadě dvouděložných rostlin , zejména v čeledi lišajovitých a jiných rostlinách podobných karafiátu , v mléčných rostlinách a příležitostně v rostlinách svlačce a sedmikrásky . V čeledi lišajovitých (Amaranthaceae) se ve vykazovaném rodu vyskytují jak druhy C 3, tak C 4 . Známými rostlinami C 4 jsou amarant , proso , kukuřice , cukrová třtina a obří čínská rákos .
Vzhledem k tomu, že fotosyntéza C 4 vznikla nejméně 65krát nezávisle na sobě v 19 různých rodinách (stav z roku 2017), hovoří se o polyphyletickém znaku.
Ve srovnání s C 3 rostliny, C 4 rostliny vystupovat , když je nedostatek vody, vysokých teplot a slunečního záření. Proto mají výhodu oproti jiným druhům rostlin ve stejných klimatických pásmech. Asi 70% všech druhů žijících v národním parku Death Valley provozuje fotosyntézu C 4 . Obecně platí, že většina všech trav C 4 roste v oblastech se zeměpisnou šířkou menší než 30 stupňů . Méně časté jsou v chladných oblastech, například v boreální zóně mezi 50. a 65. rovnoběžkou a ve vysokých nadmořských výškách. Výjimkou je tundra bez stromů v alpském pásmu, kde je sucho. K C 4 travní druhy Orinus thoroldii byl také objeven v Tibetu v nadmořské výšce okolo 5200 metrů . Obecně se nevyskytují v polárních a subpolárních oblastech (mimo 65. rovnoběžku).
Existuje několik rostlin C 4 odolných vůči chladu, které mohou odolat mrazu a zimním teplotám (−20 ° C), například traviny C 4 v Andách . Rostliny C 4 rostou také v chladných oblastech, jako je pobřeží Nového Zélandu , atlantické pobřeží Kanady a Velké Británie nebo některé bažinaté oblasti . Žádné C 4 rostliny byly označeny v případě nahých samers , mechy nebo výtrusné rostliny . Dosud není známo, proč - až na výjimky - neexistují stromy s fotosyntézou C 4 . Jen několik vzácných druhů rodu Euphorbia byly objeveny v Havaji , například Euphorbia olowaluana nebo E. herbstii (dříve známý jako E. forbesii ). Fylogenetické studie naznačují, že předchůdcem těchto stromů C 4 byla původně bylina C 4 , která se až později vyvinula na druh stromu sekundárním růstem .
Přestože rostliny C 4 na celém světě tvoří pouze přibližně 5% biomasy a 3% druhů rostlin, jsou zodpovědné za 23% fixace oxidu uhličitého. V posledních třiceti letech bylo šíření rostlin C 4 pozorováno také na teplých, slunečných místech ve střední Evropě. Většinou se jedná o prosy podobné trávy a liščí druhy. Přinejmenším dosud nebylo jejich šíření vnímáno jako ohrožení původní flóry.
identifikace
Aby bylo možné rozlišovat mezi rostlinami C 3 a C 4 , používají se různé metody: Anatomie listu (viz část níže ) již poskytuje počáteční vodítka. Radioaktivní izotopy ( 14 C) lze navíc použít k identifikaci primárního fotosyntetického produktu (krátkodobá fixace 14 CO 2 ). CO 2 kompenzace bodu také umožňuje vyvodit závěry o typu metabolismu. Rostliny C 4 se vyznačují velmi malou nebo žádnou měřitelnou fotorespirací . Nakonec z poměru izotopů 13 C / 12 C v uhlíku rostliny lze uzavřít fotosyntézu C 3 - C 4 (viz část níže ).
objev
Bez ohledu na důležitost základní metabolické cesty byly morfologické a rostlinné anatomické zvláštnosti rostlin C 4 pozorovány na konci 19. století a na počátku 20. století. Gottlieb Haberlandt takto identifikoval anatomii věnce (viz část níže) v různých travinách. Tvorba a akumulace škrobu, která probíhá v buňkách pochvy svazku, byla popsána v literatuře v roce 1944. Různě výrazné chloroplasty v buňkách pouzdra svazku nebo mezofylových buňkách (dimorfologické / dimorfní chloroplasty) pak poskytly indikaci skutečně odlišné specializace na metabolickou dráhu v roce 1955.
První biochemické studie na rostlině C 4 provedl Hugo Kortschak . Na počátku 50. let minulého století ve výzkumném ústavu cukrové třtiny na Havaji identifikoval L - malát a L - aspartát pomocí radioaktivního značení pomocí 14 CO 2 jako prvního fixačního produktu CO 2 . Jedná se o sloučeniny C 4 a odporují tak nálezům Melvina Calvina , Andrewa Bensona a Jamese Basshama . Ty ukázaly, že první metabolický produktu na CO 2 fixace v tmavé reakci je C 3 sloučeniny, 3-fosfoglycerát . Výsledky Kortschaku byly poprvé publikovány bez odkazu ve výroční zprávě ústavu v roce 1954 a ve vědecké literatuře byly zmíněny až v letech 1957 a 1962 po dalším zkoumání. K dalšímu objasnění však již nedošlo, protože výzkumná skupina neměla potřebné biochemicko-enzymologické schopnosti a znalosti pro další práci. Na druhé straně Kortschakovy výsledky odporovaly obecně uznávanému dogmatu (C 3 -) fotosyntézy prostřednictvím práce Melvina Calvina, takže Kortschak byl zastrašován i po kontaktu s výzkumnou skupinou kolem Calvina. Až v roce 1965 byly výsledky publikovány ve veřejně přístupnějším odborném časopise.
Nezávisle na Kortschaku ruský Jurij Karpilov v roce 1960 také zjistil , že prvním fixačním produktem v kukuřici byla sloučenina C 4 , ale to se stalo známým až koncem šedesátých let minulého století. Australský výzkumník rostlin Barry Osmond také dospěl k závěru, že prvním fixačním produktem byl malát , a to prostřednictvím experimentů se značením na rostlinách rodu Report (zejména Atriplex spongiosa ). Kvůli pochybnostem z profesionálního světa byly tyto výsledky zveřejněny až v roce 1967.
Pouze australští vědci Marshall Davidson Hatch a Charles Roger Slack dokázali pomocí těchto výsledků a vlastního zkoumání rozluštit biochemii metabolické dráhy. Za prvé, v roce 1966, bylo navrženo první model, ve kterém je C 3 sloučeniny (pyruvát nebo fosfoenolpyruvát) byl karboxylovaný na C 4 dikarboxylové kyseliny. Čtvrtý atom uhlíku této nově vytvořené dikarboxylové kyseliny je poté přenesen do akceptoru, takže z něj vznikne 3-fosfoglycerát. Původní C 3 sloučenina se opět regeneruje. V následujících letech byly získány další znalosti, například primární karboxylační enzym (PEP karboxyláza) a další inter- a intracelulární klíčové enzymy nové metabolické cesty byly identifikovány. S těmito údaji byli vědci schopni v roce 1971 vypracovat podrobné schéma. Výsledkem je, že metabolismus C 4 je po svých objevitelích označován také jako dráha šrafování -vůle nebo cyklus šrafování . Hatch a Slack, na druhé straně, vztaženo na metabolickou cestu jako C 4 -dikarboxylové kyseliny dráhy .
anatomie

1. CO 2 je předem fixován (A).
2. Výsledná sloučenina C 4 je transportována do sousedního oddílu (B)
3. Tam se CO 2 uvolňuje a spotřebovává v Calvinově cyklu.
4. Zbývající tělo C 3 je opět transportováno zpět a regenerováno pro další cyklus.
Rostliny C 4 lze často identifikovat na základě charakteristické anatomie listů. Cévní svazky jsou uloženy v prvním prstenci buněk pouzdra svazku ve tvaru prstence . Buňky pochvy svazku jsou pak zase obklopeny mezofylovými buňkami ve druhém prstenci (viz obrázek). Vzhledem k četným cévním svazkům jsou mezofyly a pochvy svazků přítomny v poměru přibližně 1: 1. Tato speciální struktura je také známá jako „anatomie věnce“ nebo podle výrazu „typ věnce“, který v roce 1896 vytvořil Gottlieb Haberlandt . Jak ukazují experimenty na rostlinách kukuřice, kořenový gen SCARECROW hraje důležitou roli ve vývoji korunní anatomie rostlin C 4 . Mezofyl obklopující pochvy svazku není diferencován na houbu typu C 3 nebo palisádový parenchym .
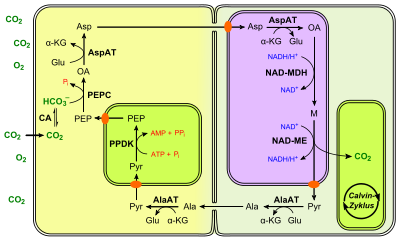
Toto speciální uspořádání také vysvětluje princip metabolické cesty C 4 , která se obvykle rozprostírá přes dva sousední typy buněk, které mají vysoký stupeň funkcionalizace. Zde je CO 2 nejprve předem fixován v mezofylových buňkách ve sloučenině C 4 . Buňky mezofylu neobsahují žádné RuBisCO. CO 2 navázaný ve formě této C4 sloučeniny je transportován do buněk pouzder svazku prostřednictvím obzvláště velkého počtu plazmodesmat a tam uvolněn. Díky svému enzymatickému vybavení mohou provádět Calvinův cyklus . Buněčné stěny buněk pouzdra svazku jsou často suberinizované , což znamená, že uvolněný CO 2 může z buňky jen stěží difundovat . Akumuluje se v buňce, takže pro RuBisCO existuje vysoká koncentrace CO 2 (asi 10krát vyšší než ve venkovním vzduchu) , kterou zavádí do Calvinova cyklu pro asimilaci . Sloučenina C 3 vytvořená během uvolňování je transportována zpět do mezofylové buňky. Pre-fixace CO 2 (v mezofylových buňkách) a skutečná asimilace uhlíku v Calvinově cyklu (ve svazkových pouzdrových buňkách) jsou tak od sebe prostorově odděleny a probíhají tedy v různých reakčních prostorech.
Toto oddělení funkcí také rozlišuje chloroplasty mezofylových a svazkových pochvových buněk některých rostlin C 4 . Chloroplasty buněk obalu pochvy dostanou hodně síly a grana chybí. Mluví se o dimorfismu chloroplastů nebo dimorfních chloroplastech . To však není nezbytně nutné pro pokračování fotosyntézy C 4 .
biochemie
Diferenciace od C 3 a CAM rostlin
Všechny zelené rostliny fotosyntetizují a vytvářejí sacharidy . Při „temné reakci“ je oxid uhličitý (CO 2 ) fixován a zabudován do sacharidů. Většina rostlin (rostliny C 3 ) provozuje mechanismus popsaný jako metabolismus C 3 , při kterém oxid uhličitý pasivně prochází průduchy do buněk a je fixován jako substrát během dne v Calvinově cyklu. Tato pasivní difúze oxidu uhličitého do buněk má při vysokých okolních teplotách nevýhodu. Za těchto podmínek musí rostliny uzavřít průduchy, aby udržely ztrátu vody transpirací v mezích a nevyschly. Zavření průduchů také ztěžuje výměnu plynu a tím i absorpci CO 2 pro fotosyntézu. Dalším problémem je, že enzym Rubisco (která opravuje CO 2 v Calvinově cyklu) má k funkci oxygenázy v vedle své karboxylázy funkce . Nízký parciální tlak CO 2 , vysoký parciální tlak O 2 a vysoké teploty podporují oxygenázovou funkci RuBisCO. V případě nežádoucí oxidace se ribulóza-1,5-bisfosfát spotřebuje a musí být regenerován pomocí fotorespirace .
Rostliny C 4 čelí problému poskytování oxidu uhličitého speciálním mechanismem. Koncentrace CO 2 pro fixaci se zvyšuje aktivně, a tím se spotřebou energie . Pro prefixaci a metabolizaci oxidu uhličitého probíhá prostorová separace (dva typy buněk: buňky mezofylu a buňky obalu cévního svazku). To umožňuje rostlinám částečně uzavřít průduchy, protože na rozdíl od rostlin C 3 nejsou omezeny jednoduchou difuzí oxidu uhličitého do buněk. Následná fixace CO 2 v Calvinově cyklu však odpovídá fixaci rostlin C 3 („temná reakce“). Rozdělení práce mezi dva reakční prostory předpokládá, že tyto dvě tkáně obsahují odlišný soubor enzymů.
Prefixační enzym PEP karboxyláza má mnohem vyšší afinitu k CO 2 než RuBisCO, který zde provádí pouze sekundární fixaci. Protože prvním hmatatelným fixačním produktem je tělo C 4 , oxaloacetát , bylo toto jméno zvoleno tak, aby se odlišovalo od rostlin s „normálním“ C 3 fotosyntetickým metabolismem.
Pre-fixace rostlin C4 je podobná jako u CAM rostlin . Posledně jmenovaný je však dočasným oddělením prefixace a Calvinova cyklu, zatímco rostliny C 4 provádějí prostorové oddělení.
Biochemie v mezofylové buňce
Metabolismus C 4 funguje v principu jako upstream pumpa CO 2 , která začíná fixací CO 2 ve formě bikarbonátu (HCO 3 - ) v mezofylové buňce. Tvorba HCO 3 - z CO 2 je katalyzována karboanhydrázou a probíhá v cytosolu.
Karboxylázy fosfoenolpyrohroznanu (PEPC) katalyzuje nevratné kondenzaci molekuly fosfoenolpyruvát (PEP) s HCO 3 - , tak, že oxalacetát je vytvořen kromě fosfátu . PEPC má velmi vysokou afinitu k PEP. Oxaloacetát se přeměňuje na L - malát („ malátotvorné činidlo“) a v některých rostlinách C 4 také na L - aspartát . Oxid uhličitý je v rovnováze s CO 2 intracelulárního prostoru a tedy nakonec s venkovním vzduchem. Vzhledem k tomu, že je již stažen z rovnováhy v buňce pouzdra svazku, usnadňuje to post-difúzi. PEPC navíc není inhibován kyslíkem.
 |
HCO 3 - P i PEP -C |

|
| Fosfoenolpyruvát (PEP) | Oxaloacetát |
Pyruvát transportovaný zpět do mezofylové buňky vstupuje do chloroplastu přes specifický translokátor, přičemž jsou s ním transportovány protony nebo sodné ionty. Tam pyruvát -fosfát dikináza převádí pyruvát na PEP. Tato neobvyklá reakce spotřebovává jak ATP, tak anorganický fosfát. Ve skutečnosti je střední fosfát z ATP (P β ) začleněn do pyruvátu.
Pyrofosfát (PP i ) uvolněný během reakce je hydrolyzován pyrofosfatázou a tak termodynamicky stažen z rovnováhy. Tato katalýza je proto nevratná. Na druhé straně PEP vstupuje do cytosolu přes specifický antiporter výměnou za anorganický fosfát (translokátor PEP-fosfát) a může tak opět kondenzovat s bikarbonátem.
Reakce v buňce pláště svazku
Způsob, jakým se oxid uhličitý opět uvolňuje a přivádí do Calvinova cyklu, se u rostlin C 4 liší. Dosud byly identifikovány tři základní typy fotosyntézy C 4 , které se liší v poskytování CO 2 během dekarboxylace v buňce pláště svazku:
- NADP + malátový enzym typu ( NADP -ME ): Malát je oxidačně dekarboxylován v chloroplastech, který katalyzuje NADP + závislý malátový enzym , čímž uvolňuje NADPH . Typickými zástupci jsou kukuřice, cukrová třtina nebo čirok .
- Typ NAD + malátového enzymu ( NAD -ME ): Zde je malát dekarboxylován v mitochondriích , který katalyzuje NAD + závislý malátový enzym se spotřebou NAD + . Uvolněný oxid uhličitý difunduje do chloroplastů. Tento typ uvolňování CO 2 ovládal zakřivený zadní amarant , proso nebo portulaka .
- Typ karboxykinázy PEP ( PEPCK ): Zde probíhají paralelně dva cykly. Jednou, jako u typu NAD, je malát přeměněn na mitochondrie. Oxaloacetát je hlavně dekarboxylován v cytosolu pomocí PEP karboxykinázy, která mu dává jméno, pomocí ATP . Tento C 4 -Stoffwechseltyp se nachází v rychle rostoucích tropických trávách, jako je například Guinea Grass ( Megathyrsus maximus ) nebo Chloris gayana .
Zatímco všechny tři typy mají v buňce mezofylu mnoho společných enzymatických reakcí (například cestu k oxaloacetátu a regeneraci PEP v chloroplastech), liší se uvolňováním CO 2 v buňce obalu svazku.
Po uvolnění CO 2 jsou fosfoenolpyruvát (PEP) nebo pyruvát transportovány zpět do mezofylové buňky plazmodesmatem. V rostlinách s typem NAD malátového enzymu se pyruvát nejprve převede na L - alanin transaminací a ten se poté transportuje.
Difúzí indukovaný zpětný tok oxidu uhličitého je obsažen v suberinové vrstvě. Pokud se CO 2 dostane zpět do mezofylové buňky, bude znovu zachycen aktivitou karboanhydrázy.
Obousměrná doprava materiálu probíhá prostřednictvím difuze. To předpokládá, že je mezi oběma buňkami vytvořen a udržován dostatečně vysoký koncentrační gradient. Protože jsou metabolity přechodu (např. Malát, pyruvát) rychle spotřebovány na místo určení, lze tohoto koncentračního gradientu dosáhnout.
NADP malátový enzym typu (NADP-ME)
Typ enzymu NADP malát je ze všech tří typů nejjednodušší. Poté, co je v cytosolu mezofylové buňky vytvořen oxaloacetát, je specifickým translokátorem (oxaloacetát / malátový antiporter) přiveden do chloroplastů. Tam malátdehydrogenáza závislá na NADP + ( EC 1.1.1.82 ) přeměňuje oxaloacetát na L -malát při konzumaci NADP . Poté, co se opět dostal z chloroplastů, prochází plazmodesmatem do buněk pochvy svazku a je transportován do chloroplastů. Eponymní malátový enzym závislý na NADP + dekarboxyluje malát na pyruvát, čímž se NADP + redukuje. Pyruvát opouští chloroplast přes specifický translokátor a vrací se do buňky mezofylu přes plasmodesmata. V chloroplastech se toto převede na PEP, jak je popsáno výše, a cyklus se uzavře.
Rostliny s NADP-dependentním malátovým enzymem často obsahují relativně velké chloroplasty a téměř žádné mitochondrie ve svých svazkových pochvách . Kromě toho se množství hromádek grana liší od neexistujících (např. V cukrové třtině a prosu) až po polovinu ve srovnání s mezofylovou buňkou (rodina lišajů); K dispozici jsou lamely Stroma. V souladu s tím je v nich fotosystém II (PS II), který se normálně nachází v grana membránách tylakoidů , sotva aktivní . Na jedné straně to znamená, že fotosyntézou není produkován téměř žádný kyslík, což dále snižuje riziko fotorespirace. Na druhou stranu neexistuje možnost lineárního přenosu elektronů ve světelné reakci fotosyntézy, která normálně generuje NADPH požadovaný v Calvinově cyklu. Pouze s jedním aktivním fotosystémem ( fotosystém I ) je primárně provozována cyklická fotofosforylace , takže je generován ATP. NADPH musí být proto k dispozici z mezofylové buňky světelnou reakcí fotosyntézy. Není však transportován přímo do buňky pouzdra svazku. Místo toho je nepřímo přenesen (společně s ATP) pomocí triozového fosfát-3-fosfoglycerátového člunku do chloroplastů buněk obalu svazku. Obvykle se zde používá dihydroxyacetonfosfát . Alternativně se NADPH tvoří v průběhu metabolismu C4, když je malát dekarboxylován na pyruvát v buňce obalu svazku.
NAD malátový enzym typu (NAD-ME)
Tento typ je o něco složitější než způsob NADP-ME. V mezofylových buňkách cytosolická aspartátaminotransferáza přeměňuje oxaloacetát na L- aspartát. K tomu se používá aminoskupina L -glutamátu, takže se stává α -ketoglutarátem. Místo malátu se jako prostředek pro přepravu uhlíku používá aspartát. Vytvořený aspartát se dostane do buňky pochvy svazku prostřednictvím plasmodesmat a je tam transportován do mitochondrií. Tam je nejprve přeměněn zpět na oxaloacetát mitochondriálním izoenzymem a zároveň α-ketoglutarát reaguje za vzniku L- glutamátu. Oxalacetát se pak sníží na malát od mitochondriální NAD + -dependentní malát dehydrogenáza se spotřebou NADH. Nakonec se CO 2 uvolňuje stejnojmenným malátovým enzymem závislým na NAD + ( EC 1.1.1.39 ) a chloroplasty v těsné blízkosti difundují. NADH získaný v této reakci je pak opět k dispozici pro oxidaci oxaloacetátu. Na rozdíl od typu NADP -ME není produkovaný pyruvát přiveden zpět do mezofylové buňky přímo prostřednictvím plasmodesmata, ale jako L -alanin. Tato je v obou buňkách vzájemně přeměněna alaninaminotransferázou, přičemž L- glutamát působí také jako donor aminoskupiny. Pyruvát je nakonec regenerován na PEP, jak bylo popsáno dříve. Různé koncentrační gradienty vedou k cílené difúzi do mezofylové buňky.
Na rozdíl od typu NADP vykazují chloroplasty buněk obalu svazku vysokou aktivitu PS II. Kromě toho existuje mnoho dalších a častěji zahrnutých větších mitochondrií.
PEP karboxykinázový typ (PEPCK)
Cesta PEPCK je ze všech tří nejsložitější, protože dva cykly probíhají paralelně.
Ten mnohem silněji operovaný cyklus je založen na transportu L -aspartátu. To je produkováno cytosolovou aspartátaminotransferázou z oxaloacetátu, podobnou typu NAD-ME. L- aspartát je transportován přes plasmodesmata do buňky pouzdra svazku, kde je nejprve přeměněn na oxaloacetát (také cytosolickou aspartátaminotransferázou). Název, na kterém je tento podtyp založen, je založen na reakci, při které je oxaloacetát dekarboxylován na PEP. To je konkrétně katalyzováno PEP karboxykinázou ( EC 4.1.1.49 ) se spotřebou ATP. PEP difunduje zpět do mezofylové buňky bez jakékoli další reakce a uzavírá tam cyklus.
Druhá provozovaná trasa je podobná trase NADP-ME. Cytosolicky produkovaný oxaloacetát se v chloroplastech mezofylové buňky převádí na L -malát , který katalyzuje spotřebu NADPH na NADP + závislou malát dehydrogenázu. To se dostává do buňky pochvy svazku prostřednictvím plasmodesmata, ale je transportováno do mitochondrií na rozdíl od dráhy NADP-ME. Tam malátový enzym závislý na NAD + uvolňuje oxid uhličitý (analogický s dráhou NAD -ME). U typu PEPCK se požadavek na ATP buněk obalu svazku zvyšuje reakcí PEPCK. Aby to pokryly, mitochondrie používají uvolněný NADH pro dýchací řetězec pro syntézu ATP. Pyruvát přivezený z mitochondrií neprochází plazmodesmatem přímo zpět do mezofylové buňky, ale prostřednictvím alaninu. Stejně jako u dráhy NAD-ME je tato přeměněna vzájemnou konverzí alaninaminotransferázou.
Grana v chloroplastech mezofylových a svazkových pochvových buněk jsou poněkud stejně výrazná.
nařízení
Tři klíčové enzymy nezbytné pro dělbu práce jsou regulovány světlem, takže základní metabolismus C4 se provádí pouze během dne.
- PEP karboxyláza (PEPC) je v noci v neaktivní formě. Ve srovnání s jeho substrátem PEP je afinita výrazně snížena. Kromě toho je PEPC účinně inhibován malátem. Toto má zabránit zbytečné nevratné konzumaci PEP. Aktivita enzymu je však - stejně jako u rostlin CAM - navíc regulována reverzibilní fosforylací na serinovém zbytku . Během dne je aktivována proteinová serinkináza, která zase přenáší fosfátové skupiny na PEPC. Výsledkem je, že PEPC je po vystavení světlu přeměněn na svou katalyticky aktivní formu. Aktivní, fosforylovaná forma je také mnohem méně citlivá na malát. Ve tmě zodpovědná fosfatáza defosforyluje PEPC a tím ji deaktivuje.

- Pyruvát fosfát dikináza (PPDK) je také regulována lehkou fosforylací. To se provádí bifunkční serin / threonin kinázou - regulačním proteinem (zkráceně PDRP nebo RP). Katalyzuje jak přenos fosfátové skupiny na threoninový zbytek PPDK (funkce kinázy), tak její odstranění (funkce fosfatázy). Je zajímavé, že na rozdíl od většiny kináz regulační protein jako dárce P nepoužívá ATP, ale ADP . Kromě toho, na rozdíl od většiny fosfatáz, defosforylace neprobíhá pomocí vody, ale anorganického fosfátu. Na rozdíl od PEPC je fosforylovaná forma PPDK neaktivní. ADP, substrát pro kinázu, je také silným a kompetitivním inhibitorem fosfatázy. PDRP je proto regulován hladinou ADP stromatu: koncentrace ADP je za světla nízká, ale ve tmě vysoká. Výsledkem je, že PPDK je za světla defosforylován a tím zapnut. Ve tmě se to děje naopak, PDRP fosforyluje PPDK, což jej deaktivuje.
- Další kontrolní mechanismus se nachází u NADP malátdehydrogenázy. Podobně jako u jiných chloroplastických enzymů (např. Ribulózofosfátkinázy nebo fruktózo-1,6-bisfosfatázy ) je tento regulován redoxním stavem způsobem závislým na světle. Redukovaný thioredoxin zprostředkovává jejich aktivaci redukcí disulfidového můstku (–S - S–) na vnější straně příslušného proteinu na cystein (–SH). Že samotný thioredoxin je tvořen ferredoxinem , který katalyzuje ferredoxin thioredoxin reduktázu . Ferredoxiny se vyrábějí pouze ve fotosystému I při expozici.
Speciální formy fotosyntézy C 4
C 4 fotosyntéza bez koronální anatomie
Byly objeveny suchozemské rostliny, které ačkoliv provádějí fotosyntézu C 4 , nemají koronální anatomii jako většina rostlin C 4 . Čtyři druhy patřící do rodiny husí, Bienertia sinuspersici , Bienertia cycloptera , Suaeda aralocaspica a Bienertia kavirense , provádějí tuto metabolickou cestu v buňce.
Tyto rostliny rostou v pouštích -gegenden: Bienertia sinuspersici v zemích kolem Perského zálivu , Bienertia cycloptera v oblasti Turecko, Afghánistán a Írán, Bienertia kavirense v íránské solné poušti ( Dasht -e Kavir ) a Suaeda aralocaspica , solná rostlina ve střední části Asie.
Stejně jako u rostlin C 4 s anatomií koruny je fotosyntézy C 4 dosaženo prostorovým dělením prefixace CO 2 a skutečnou konečnou fixací v Calvinově cyklu, který zde probíhá intracelulárně . Výše uvedené rostliny mají fotosyntézu C 4 typu NAD-ME.
U Suaeda aralocaspica najdeme dlouhé palisádové parenchymové buňky , ve kterých se vnější (distální) oblast používá k prefixaci CO 2 a ve kterých se vnitřní (proximální) oblast používá k fixaci v Calvinově cyklu. Velká vakuola odděluje dva reakční prostory. Tyto Bienertia druhy vykazují odlišnou strukturu. Na okraji je tenké cytosolické oddělení a uprostřed neobvyklé centrální oddělení se spoustou chloroplastů. I zde existuje prostorové rozdělení podobné tomu v anatomii koruny mezi pre-fixací pomocí PEP a fixací podle RuBisCO.
Ve fotosyntéze C 4, která probíhá v buňce, existují dva různé typy chloroplastů („dimorfní chloroplasty“), které se liší svou biochemií, skladováním škrobu a ultrastrukturou. Grana jsou špatně vyvinutá v chloroplastech, které jsou na vnější straně , téměř neukládají žádný škrob a enzym PPDK je tam aktivní pro tvorbu PEP. Ostatní „dovnitř“ chloroplasty mají RuBisCO, dobře vyvinutou Granu a ukládají škrob. Tyto rozdíly jsou analogické rozdílům příslušných chloroplastů v mezofylových buňkách a buňkách pochvy svazku. Cytoskelet zajišťuje oddělení těchto funkčně různých chloroplasty v buňce.
Mitochondrie a peroxisomy jsou také spojeny s „vnitřními“ chloroplasty . Tímto způsobem se oxid uhličitý uvolněný během dekarboxylace malátu dostává do těsné blízkosti RuBisCO. Rovněž zvyšuje pravděpodobnost , že oxid uhličitý uvolněný během metabolické dráhy fotorespirace bude okamžitě znovu fixován.
Lze předpokládat, že mořské macroalga Udotea flabellum a jednobuněčné rozsivky Thalassiosira weissflogii rovněž provádět C 4 fotosyntézu ve stejné buňce.
Fakultativní fotosyntéza C 4
Fotosyntéza C 4 byla identifikována v kopřivě , sladkovodní rostlině, přestože nemá korunní anatomii. Pokud je obsah CO 2 ve vodě vysoký, probíhá fotosyntéza C 3 . Když koncentrace CO 2 klesne, kopřiva zemní se přepne na metabolismus C 4 , takže zde hovoříme o volitelné rostlině C 4 .
Přestože HCO 3 - je ve vodě přítomen ve vyšší koncentraci než CO 2 , rostlina absorbuje oxid uhličitý. Je to proto, že jejich adaxiální stěny mají nízkou hodnotu pH , což posouvá rovnováhu HCO 3 - a CO 2 ve prospěch CO 2 . CO 2 je předem fixován a přiveden do chloroplastu v metabolismu C 4 typu NADP-ME a tam obohacen.
Při vysokých teplotách má metabolismus C 4 koncentrující CO 2 v koncentraci CO 2 výhody oproti jiným sladkovodním rostlinám C 3 . Během dne se obsah O 2 ve vodě zvyšuje, zatímco obsah CO 2 klesá. CO 2 navíc nemůže difundovat do vody tak rychle jako ve vzduchu a ztráty způsobené fotorespirací se zvyšují. Mletá kopřiva je stále schopna provádět efektivní fotosyntézu.
Dalším zástupcem je například deštník ( Eleocharis vivipara ), vodní rostlina patřící ke spěchům . Když je ponořen, provádí fotosyntézu C 3 . Na C 4 se však přepne , jakmile v zemi vyroste. Jednotlivé stonky nad vodní hladinou mohou také přejít na fotosyntézu C 4 .
C 4 CAM zprostředkovatelé

Metabolismus Crassulacean kyselina (CAM), jak je C 4 -Photosynthese CO 2 -Anreicherungspumpe. Pre- a finální fixace CO 2 však neprobíhá prostorově jako v případě rostlin C 4 , ale tyto dva procesy jsou od sebe časově odděleny. Rostliny CAM zároveň provádějí klasickou fotosyntézu C 3 . K tomu dochází například ve fázích II a IV povinných zařízení CAM. Alternativně, C 3 -CAM druhy byly zjištěno, že pouze spínač do režimu CAM po indukované klíče stimulem , jako je ospalost a slanosti. Ve všech případech stejný rostlinná buňka funguje jak CAM a C 3 metabolismus.
Naproti tomu pro rostliny C 4 existuje velmi málo příkladů, že metabolismus CAM a C4 se provádí ve stejné rostlině. Většina rostlin C4 jsou trávy, ve kterých se nevyskytuje CAM, zatímco fotosyntéza C4 nebyla nikdy detekována u typických rostlin CAM, jako jsou orchideje nebo bromélie . Takže v rodině portulacaceae jste objevili jen několik druhů, které mohou využívat obě cesty, jako je Portulaca grandiflora , portulaka letní nebo portulaka Mundula . CAM probíhá v sukulentních buňkách uvnitř stonku a listu, zatímco C 4 fotosyntéza dominuje ve vnějších listových buňkách. Proto nejsou obě metabolické cesty provozovány ve stejné buňce, což naznačuje, že fotosyntéza CAM a C 4 jsou nekompatibilní.
Je k tomu uvedeno několik důvodů. Je biochemicky obtížné regulovat obě metabolické cesty právě kvůli jejich podobnosti. Obě cesty jsou navíc založeny na různých anatomických charakteristikách a transportních mechanismech. Tyto specializace jsou pro funkci zásadní, ale nelze je kombinovat. Konečně dvě souběžná měření koncentrace CO 2 v listu nevedou k žádné ekologické výhodě. První evoluční kroky ve vývoji z rostlin C 3 se navíc zásadně liší.
„ Meziprodukty C 3 -C 4 “
Řada C 3 rostlin má základní vlastnosti C 4 rostliny. Ukazují C 4 -typickou anatomickou organizaci listů se zelenou mezofylovou a svazkovou pochvou a ve skutečnosti koncentrují oxid uhličitý v pochvách svazku. Navíc jejich kompenzační bod CO 2 leží mezi rostlinami C 3 a C 4 . Na druhé straně neprovádějí charakteristický transport C4 dikarboxylových kyselin jako všechny rostliny C4 .
Tyto rostliny byly chybně označovány jako „C 3 -C 4 (meziprodukty) rostlin“, nebo C 3 -C 4 smíšené formy vzhledem ke své anatomické podobnosti , ale toto je Není vhodné vzhledem k biochemické rozdíly a zásadně odlišné povahy CO 2 mechanismus koncentrace.
Biochemický základ těchto rostlin je známý jako C 2 fotosyntéza , která je založena na fotorespiračních procesech. Pokud RuBisCO používá jako substrát místo oxidu uhličitého kyslík, vzniká 2-fosfoglycerát , který se regeneruje složitým procesem. V průběhu fotorespirace, mimo jiné dvě molekuly glycinu přeměněné na serin a CO 2 komplexem glycin dekarboxylázy (GDC). V rostlinách s fotosyntézou C 2 (a C 4 ) je GDC lokalizována a aktivní pouze ve svazkových pochvových buňkách, takže glycin transportovaný z mezofylových buněk je tam dekarboxylován a obohacen chloroplasty. Díky této kyvadlové přepravě glycinu, sloučeniny C 2 , byla tato zvláštní forma metabolismu nazývána „ fotosyntéza C 2 “. Výhodou tohoto raketoplánu C 2 je skutečnost, že - pokud by se uvolnil CO 2 - měl by velmi dlouhou difúzní cestu několika buňkami ven z listu. Tím se výrazně zvyšuje šance na znovuzískání. Kromě toho je CO 2 lokálně koncentrován v buňce pláště svazku díky aktivitě GDC, takže tam je fotorespirace výrazně snížena.
C 2 rostliny byly objeveny například v rodech ze solných bylin , slunovraty , prosa , Flaveria a Moricandia . Převážnou část zkoumaných tvoří eudikotyledony , přestože většina rostlin C 4 patří mezi jednoděložné rostliny .
Podle novější definice, C 3 -C 4 -meziprodukt rostliny jsou nejen považovány za rostliny, které provádějí na C 2 -photosynthesis. Uvádí také rostliny, které jsou fylogeneticky obecně mezi čistě C 3 a C 4 rostlin.
význam
Ekofyziologické aspekty
Vývoj metabolismu C 4 je biochemickou adaptací na klesající koncentraci CO 2 v atmosféře. Díky metabolismu C 4 s aktivní pumpou CO 2 má rostlina několik ekologických výhod oproti rostlinám C 3 , protože koncentrace oxidu uhličitého kolem RuBisCO se při spotřebě energie výrazně zvyšuje. Na jedné straně to výrazně snižuje ztráty fotocitlivostí. Zatímco rostliny C 3 ztrácejí nejméně 30% fotosynteticky získaného oxidu uhličitého, rostliny C 4 se mohou vyhnout fotorespiraci i za stoupajících teplot. Tato ekofyziologická výhoda je zvláště patrná při teplotách nad 25 ° C, takže rostliny C 4 jsou široce používány v horkém podnebí. Když teplota stoupá, kyslík se rozpouští lépe než CO 2 , takže v rostlinách C 3 dochází k větším ztrátám díky fotorespiraci v důsledku aktivity oxygenázy RuBisCO, kterou lze v rostlinách C 4 omezit nebo úplně potlačit. Právě v těchto oblastech začínají mít největší vliv negativní efekty fotorespirace z C 3 rostlin. Dokonce i v rámci jednoho roku, suchá a horká léta způsobit změnu z C 3 až C 4 trávy na trávnících, například: V chladném jarní louka bluegrass nebo červená pštros travní dominuje , ale když jsou letní vysoké teploty, C 4 trávy jako jak krvavě rudá dominuje, prstové proso zaroste.
Kromě toho C podporuje 4 -metabolismus v podmínkách přirozeného růstu požadavky na dusík . U rostlin C 4 je nižší, protože vyžadují méně RuBisCO. To může fungovat efektivněji díky vyšší saturaci CO 2 (70 µmol / litr), ztráty způsobené fotorespirací jsou minimální. Na druhé straně RuBisCO rostlin C 3 musí vystačit s přibližně 10krát nižšími koncentracemi CO 2 , aby enzym fungoval hluboko pod maximální reakční rychlostí. Snaží se to kompenzovat akumulací vysokého množství enzymu v chloroplastech. Bylo vypočteno, že při teplotě 30 ° C ± C 4 list potřeby o 13-20% z množství Rubisco na C 3 listu za účelem dosažení stejné rychlosti fotosyntézy (v nasyceném intenzity světla). Je však třeba poznamenat, že typické C4 enzymy - jako PPDK a PEPC - vedou ke zvýšené potřebě dusíku. Celkově se odhaduje, že takzvaná účinnost využití dusíku (NUE, účinnost využití dusíku ) v závodech C 4 je nejméně dvakrát vyšší než v závodech C 3 . Zvyšující se pozornost také získává tropický C 4 -Buttergräser spojený s bakteriemi fixujícími dusík, které jsou, a proto sotva vyžadují další hnojení .
Aktivní zvýšení oxidu uhličitého má vliv na CO 2 saturační křivku a CO 2, kompenzační bod. Ta je mnohem nižší v C 4 zařízení s 0,0005% objemových nebo méně, než v C 3 zařízení s 0,0100% objemových. Klesající koncentrace CO 2 proto upřednostňují rostliny C 4 ; Pokud například pěstujete rostlinu C 3 a C 4 v uzavřené nádobě za stálého světla, budou oba soutěžit o oxid uhličitý. Rostlina C 4 to dělá lépe, takže ve skutečnosti způsobí, že rostlina C 3 zemře. Naproti tomu zvýšení koncentrace CO 2 nevede ke zvýšení fotosyntetické kapacity rostlin C 4 . Zvýšení hodnot CO 2 v atmosféře dává přednost rostlinám C 3 . Důvodem je, že na rozdíl od metabolismu C 4 je metabolismus C 3 vždy závislý na rychlosti difúze oxidu uhličitého. Amaranthus palmeri má celosvětově nejvyšší míru fotosyntézy, to je 80 µmol CO 2 · m −2 · s −1 s koncentrací oxidu uhličitého 325 µmol · mol −1 CO 2 (ve srovnání s tím má kukuřice rychlost 60 µmol · m −2 · s - 1 , u pšenice a rýže je to 35 µmol · m −2 · s −1 ).
Rostliny C 4 jsou nejvíce vynikajícími rostlinami C 3 v tom, že je lze ekonomičtěji využívat jejich voda Kohlenstoffdioxidanreicherung (WUE, účinnost využití vody , dt.: Účinnost využití vody ): Optimální teplota růstu je mezi 30 a 40 ° C, pro C 3 -Rostliny naopak při 20 až 30 ° C. Bylinná rostlina C 4 Tidestromia oblongifolia nalezená v Údolí smrti dosahuje svého maxima fotosyntézy při teplotách 45 až 50 ° C. Rostliny C 4 mohou do značné míry, ale ne zcela, uzavřít své průduchy na delší dobu, aby se snížily ztráty vody, aniž by došlo k ohrožení rovnováhy uhlíku. Zatímco rostliny C 4 potřebují 230 až 250 ml vody k vytvoření 1 g sušiny, potřeba rostlin C 3 je dvakrát až třikrát vyšší.
Kvůli čerpadlu CO 2 je energetická potřeba závodů C 4 vyšší než energie zařízení C 3 . V případě typu NADP-ME a typu NAD-ME je to například 5 ATP a 2 NADPH na fixní molekulu CO 2 . Rostliny C 3 vyžadují 3 ATP a 2 NADPH na fixní molekulu CO 2 , tyto hodnoty neberou v úvahu ztráty fotorespirace. Rostliny C 4 typu PEPCK vyžadují 3,6 ATP a 2,3 NADPH na fixní molekulu CO 2 . Díky zvýšené cyklické fotofosforylaci (fotosystém I) však lze snadno zpřístupnit také ATP. Vzhledem ke zvýšené potřebě energie vyžadují rostliny C 4 více světla ve srovnání s rostlinami C 3 . To vysvětluje, proč jsou upřednostňováni na velmi slunných místech. Bod kompenzace světla je také vyšší ve srovnání s rostlinami C 3 , ale za přirozených světelných podmínek nedochází k nasycení.
Naproti tomu velmi málo rostlin C 4 se vyskytuje v chladném a chladném podnebí a jsou zjevně nižší než rostliny C 3 . Nejprve se předpokládalo, že metabolismus C4 je špatně přizpůsoben chladu, zatímco při vysokých teplotách vykazuje výhody. Nejprve k tomu byly uvedeny fyziologické důvody, například kvůli labilitě enzymů zapojených do metabolismu C 4 . Další teorie předpokládá, že všechny rostliny C 4 pocházejí z rostlin C 3, které se přizpůsobily horkému a suchému podnebí. Výsledné rostliny se proto již nemohly šířit v chladných oblastech. Vzhledem k tomu, že některé rostliny C 4 si přesto vytvořily určitou toleranci vůči chladu, nezdá se chlad sám o sobě nepřekonatelnou bariérou. Tyto rostliny však stále potřebují teplé nebo slané mikrobyby , například jižní alpské svahy, které během dne dostávají dostatek slunečního světla, a proto jsou dostatečně teplé.
Ekonomické aspekty
Rostliny C 4 lze použít k výrobě biomasy pro energii . Čínský rákos dosahuje výnosů 15 až 25 tun sušiny na hektar a rok. V USA se jako základ pro biopalivo používá kukuřice, v Brazílii je to hlavně cukrová třtina . Alternativně jsou diskutovány trávy C4 odolné vůči chladu, jako je rozinková tráva pro produkci celulózového ethanolu . Za uměle optimalizovaných podmínek, například prostřednictvím adekvátního zavlažování, lze obecně zvýšit produktivitu rostlin C4 . Plantáže kukuřice nebo cukrové třtiny, jsou -li dostatečně hnojeny a zavlažovány, patří k nejproduktivnějším zemědělským ekosystémům.
Jedním z problémů rostoucí světové populace ( přelidnění ) je nedostatek potravinových zásob, zejména proto, že stále méně půdy bude k dispozici pro zemědělské využití. Jedním ze způsobů, jak zvýšit výnosy plodin, by mohla být fotosyntéza C4 . To je zvláště výhodné v teplejších oblastech světa, protože tam C 3 rostliny, jako je například rýže , jsou vždy nižší než na C 4 rostliny, pokud jde o jejich produktivity fotosyntézy. Jeden přístup k tomu je již v přírodě přítomen, ale ne kultivovatelné rostliny C 4 , jako je barnyardgrass podobné rýžovému zrnu k růstu . Kuřecí proso používá fotosyntézu C 4 typu PEPCK.
Alternativně jsou úvahy a pokusy zvýšit rychlost fotosyntézy v C 3 rostlin zaváděním různých genů z C 4 rostlin, například v rýži ( „C 4 rýže“ ). Zatím moc nadějní nebyli. Jedním z důvodů, proč rýže nebo blízcí příbuzní nebyli schopni vytvořit C4 fotosyntézu, je to, že existuje pouze jeden C4 -související PEPC enzym. To se však konkrétně týká asimilace amoniaku v chloroplastu, takže jej nelze použít pro jiný úkol. To také brání evoluční expresi ve směru C 4 fotosyntézy.
V zásadě existují dva možné způsoby transformace C 3 rostliny do C 4 rostliny, a tak zvýšit produktivitu:
- Buď jeden vychází z jednobuněčného modelu, ve kterém fotosyntéza C 4 neprobíhá ve dvou různých buňkách, jako obvykle, ale ve stejné buňce. V přírodě také existují rostliny, které zvládají prostorové oddělení mezi pre-fixací CO 2 a Calvinovým cyklem v jedné a téže buňce (viz část výše ). Pro konverzi by člověk musel provést různé kroky, aby do buňky vnesl C4 -specifické vlastnosti. Takže mimo jiné. v cytosolu bude přítomen karboxylační enzym PEPC , aktivita karboanhydrázy chloroplastů bude přenesena do cytosolu, účinné transportéry budou zavedeny do chloroplastové membrány a bude dosaženo prostorové separace PEPC a RuBisCO.
- Nebo se vychází z dvoučlánkového modelu, ve kterém se pokouší dosáhnout anatomické specializace s koronální anatomií, jako je tomu u většiny rostlin C 4 . To by však vyžadovalo mnohem více genetických zásahů než jednobuněčný model, zejména proto, že by musel být také vytvořen nový specializovaný buněčný typ.
Izotopová diskriminace
Rostliny C 4 lze rozeznat podle poměru dvou izotopů uhlíku 12 C a 13 C. Dva izotopy se vyskytují v zemské atmosféře s 98,89% a 1,11% (radioaktivní izotop 14 C v tomto kontextu nehraje roli). Přestože jsou chemické vlastnosti 12 CO 2 a 13 CO 2 podobné, RuBisCO reaguje rychleji s lehčím izotopem uhlíku. Důvodem je na jedné straně to, že těžší 13 CO 2 difunduje pomaleji. Na druhou stranu má RuBisCO vnitřní hodnotu diskriminace vůči 13 CO 2 . V rostlinách C 3 tato diskriminace izotopů znamená, že poměr 12 C / 13 C je vyšší než v atmosféře.
Poměr je vyjádřen kvocientem, hodnotou δ- 13 C:
Určitý vápenec je definován jako standard ( Pee Dee Belemnite ), hodnota ve vzorku je určena hmotnostní spektrometrií . Produkty fotosyntézy C 3 mají hodnoty δ- 13 C v průměru −28 ‰.
PEP karboxyláza preferuje 12 CO 2 méně silně než RubisCO, ale v rostlinách C 4 je téměř veškerý CO 2 předem fixován PEP karboxylázou. Vzhledem k vysoké vnitřní koncentraci CO 2 v buňkách pláště svazku nepřichází v úvahu ani diskriminace vůči RubisCO. To má za následek hodnotu δ- 13 C v průměru −14 ‰ pro rostliny C 4 .
Určením δ- 13 C hodnotu pomocí hmotnostní spektrometrie, lze tedy rozlišit fotosyntetických výrobky z C 3 a C 4 rostlin, který je široce používán. V potravinářském analýze, původ cukr ( sacharóza ), může být určena, například, zda cukr pochází z cukrové řepy (C 3 ), nebo z cukrové třtiny (C 4 ), nebo zda je med byl „natažené“ s třtinového cukru . Analýzou (fosilních) vzorků tuku, kostí nebo zubů ze zvířat lze vyvodit závěry, zda a kdy využívaly pastviny například s rostlinami C 4 . To může být také kombinovány se studiemi ze vzorků půdy, takže historické změny ve vegetaci, jako je změna z C 3 až C 4 trav, lze dokumentovat.
Srovnání C 3 , C 4 a CAM rostlin
| charakteristický | C 3 | C 4 | VAČKA |
|---|---|---|---|
| Podíl pocení [ml (H 2 O) na g (C)] | 450-900 | 250-350 | 18–100 (v noci) nebo 150–600 (přes den) |
| Účinnost využití vody (sušina produkovaná vg na g ztráty vody) | 1,05-2,22 | 2,85-4,00 | 8,0-55,0 |
| maximální rychlost fotosyntézy [µmol fixní CO 2 / listová plocha m 2 · s] | 20-40 | 30-60 | 5–12 (za světla) nebo 6–10 (za tmy) |
| Optimální teplota | 15-25 ° C | 30-47 ° C | 35 ° C |
| Zisk v sušině ([tuny / hektar · rok]) | 10-25 | 40-80 | 6-10 |
| 8- 13 C hodnot | −32 až −20 ‰ | −17 až −9 ‰ | −17 až −9 ‰ (sucho) nebo −32 až −20 ‰ (dobře zásobené H 2 O) |
vývoj
Vzhled a šíření prvních rostlin C 4
První výskyt rostlin C 4 je stále předmětem výzkumu. K datování se používají různé techniky, jako jsou analýzy DNA ( fylogenetické studie), geochemické signály (např. Poměr izotopů 12 C a 13 C), fosilie a mikrofosilie ( pyl , fytolity). Metabolismus C 4 vznikl až 61krát nezávisle na sobě v 19 rodinách rostlin.
Přibývá důkazů, že původ C 4 fotosyntézy se datuje zhruba před 30 miliony let během oligocénu . Toto období charakterizují klesající teploty a koncentrace oxidu uhličitého (od přibližně 1 000 ppm do méně než 500 ppm). Před deseti miliony let hladiny oxidu uhličitého nadále klesaly pod 300 ppm. Atmosférická koncentrace O 2 navíc stoupla z 18% na dnešních 21%. Výsledný nepříznivý poměr kyslíku k oxidu uhličitému pro fotosyntézu C 3 (vysoká fotorespirace) je považován za primární evoluční kardiostimulátor pro vývoj opatření zaměřujících se na CO 2 v rostlinách, což podporovalo vývoj metabolismu C 4 a CAM. Ve vodních rostlinách byl zpočátku pravděpodobně vysoký selekční tlak , který vedl k metabolismu C4 nebo CAM. Klimatické změny navíc znamenaly, že zejména teplejší oblasti se staly vyprahlejšími, což muselo dále upřednostňovat výběr pro rostliny C 4 a CAM.
Z přibližně 8 100 druhů rostlin C 4 z 19 čeledí krytosemenných rostlin tvoří přibližně 80% trávy a rostliny kyselé trávy (stav z roku 2017). Asi 5 000 trav zahrnuje nejstarší rostliny C 4 ( Chloridoideae ), ale existují i fylogeneticky velmi mladé druhy, jako je Neurachne . Téměř 1300 druhů patří do rodiny kyselých tráv, která se vyvinula ze šesti kladů . Zbývající rostliny C 4 patří mezi eudicotyledony (asi 1 800 druhů ze 16 rodin). Trávy C 4 však nemusí nutně pocházet před eudicotyledony C 4 , protože obě skupiny obsahují velmi staré a velmi nové linie.
Klesající koncentrace CO 2 jsou považovány za evoluční spouštěč a obecný základní požadavek pro vývoj rostlin C 4 . Jelikož fotosyntéza C 4 se objevila také během 30 milionů let po prvním evolučním spurtu, musely hrát hlavní roli další místní faktory. Existuje šest globálních center, která jsou považována za jádro mnoha C 4 eudicotyledonů a některých trav: (jihozápadní) severní a (střední) Jižní Amerika , Jižní Afrika , severovýchodní Afrika a Arábie , západní a střední Asie a Austrálie . Tyto oblasti jsou obvykle teplé a suché až polosuché, ale v létě dochází k pravidelným srážkám. Také klouzavé , písčité nebo suché půdy podporují vznik a šíření rostlin C 4 , protože snižují dostupnost vody . To by vysvětlovalo, proč se rostliny C 4 naopak zřídka vyskytují ve vlhkých, zastíněných lesích. Dalším faktorem jsou lokality s vysokým výskytem světla, protože metabolismus C 4 vyžaduje více energie. Asi před 23 miliony let byly rostliny C 4 již rozšířené v Novém světě , Africe a jižní Asii. Šíření bylo postupné, zejména v nižších a středních zeměpisných šířkách . Druhá fáze evolučního vývoje rostlin C4 se nachází na počátku miocénu , během kterého došlo k dalšímu snížení koncentrace CO 2 .
Globální, ekologický význam byl důsledkem velmi silného rozšíření trav C4 , a tím i rozšíření ekosystémů, kterým dominovaly rostliny C 4 v pastvinách a oblastech savan . Stalo se to na konci miocénu a na začátku pliocénu před 2 až 8 miliony let. Posunutí C 3 trav a stromů krajiny od C 4 travnatých krajin byl podporován rostoucí vyprahlosti a koevoluce z velkých pasoucích se zvířat (Severní Amerika) a regionálními suchých obdobích a Bush požárů (Afrika, jižní Asie). To odráží konkurenci mezi travami C 4 a rostoucími (C 3 ) stromy, protože stromky těchto stromů by nakonec přerostly a zastínily trávu C 4 bez opakujících se „poruch“ (například požár keřů) . Po požáru se však trávy C 4 dokážou zotavit rychleji než rostliny C 3 , zejména v suchých oblastech . Rychlý růst mnoha trav navíc podporuje další požáry. Traviny C 4 proto dominují v oblastech s pravidelnými suchými obdobími a keřovými požáry, zatímco ve vlhkých oblastech převládají krajiny stromů.
Zda C 4 fotosyntéza proběhla mnohem dříve, zatím nelze s konečnou platností uzavřít. Například hodnoty izotopů z mořských sedimentů v Africe dnes lze interpretovat tak , že první rostliny C 4 existovaly již před 90 miliony let. Hypoteticky ještě dřívějším možným časovým bodem v čase by byl přechod z pozdního karbonu do raného permu asi před 300 miliony let, protože fotorespirace začala být znatelná díky převládajícímu poměru kyslíku a oxidu uhličitého. Pravděpodobně během tohoto období se objevily mechanismy koncentrace oxidu uhličitého v řasách, aby bylo možné čelit prudce klesajícím koncentracím CO 2 ( 2 500 ppm až přibližně 1 000 ppm) a stoupajícím koncentracím O 2 (přibližně 30%).
Vývoj metabolismu C 4
Prostřednictvím fylogenetických studií rostlin C 3 a C 4 a C 3 – C 4 mezistupně byl vyvinut model, který popisuje přechod z C 3 na C 4 fotosyntézu. To zahrnuje několik biochemických a anatomických změn a lze je shrnout do následujících zastřešujících vývojových kroků:
- Genetické požadavky
- Tvorba (proto) korunní anatomie
- Založení C 2 fotosyntézy
- Vývoj kompletního metabolismu C4 dikarboxylových kyselin
- další optimalizace
Každý z uvedených kroků nabízí oproti poslední fázi vývoje evoluční výhodu. To by také vysvětlovalo, proč by mohl vývoj probíhat různými a nezávislými způsoby. Metabolismus C 4 nevznikl ani ze specifické biochemické cesty, ani z určité anatomické struktury (pouze reakce CA a PEPC mají všechny rostliny C 4 společné). Je výsledkem kombinace vlastností, jejichž kombinovaný vzhled naznačuje určitou podmínku - fotosyntézu C 4 . Někteří autoři proto v literatuře používají termín „C 4 - syndrom “.
Základní genetické požadavky
Vývoj z C 3 až C 4 metabolismu je usnadněna, protože mnoho biochemických reakcí již se vyskytují v podobné formě v C 3 rostlin. Dané enzymy se však účastní reakcí, které nemusí nutně probíhat ve fotosynteticky aktivní tkáni.
Ve skutečnosti jsou všechny enzymy zahrnuté v C 4 fotosyntéze původně odvozeny od nefotosyntetických izoforem a jsou zapojeny do dalších úkolů. Regulace enzymu potřebného pro novou funkci se také mění. To je nejlépe dokumentováno pomocí PEPC. Na rozdíl od nefotosyntetického PEPC vykazuje „C 4 “ PEPC sníženou afinitu k PEP, ale zvýšenou afinitu k bikarbonátu. Alosterická inhibice aspartátem a malátem je nižší, ve srovnání s glukóza-6-fosfátem a glycinem je vyšší. Všechny změny jsou založeny pouze na drobných genetických rozdílech.
Základním požadavkem pro konverzi enzymů zapojených do metabolismu C4 je přítomnost nadbytečných genů v genomu, například v důsledku genových duplikací. V důsledku toho mohou být genové kopie těchto enzymů vystaveny různým mutacím, aniž by to bylo pro rostlinu bezprostředně smrtelné. Tyto mutace zahrnují vypnutí specifické pro buňku nebo přizpůsobení katalytickým vlastnostem a kinetice odpovídajících enzymů nebo vývoj koronární anatomie, která je nezbytná pro metabolismus C4 . Je také vyžadován nový typ regulace enzymů s tím spojený. V případě trav mohla duplikace genomu, ke které došlo zhruba před 70 miliony let, přispět k vícenásobnému výskytu C 4 fotosyntézy.
Proto-věnec anatomie
Za první krok je považován vývoj zásadního anatomického základu metabolismu C 4 : koronární anatomie. Tím je zajištěno, že transport předem fixovaného oxidu uhličitého z mezofylových buněk (M) do buněk pouzdra svazku (BS) může probíhat co nejrychleji. V ideálním případě jsou oba typy buněk v přímém kontaktu. Jedním krokem v tomto směru je zvýšit počet cévních svazků v (planárním) listu, což také zvyšuje strukturální integritu listu. Následuje „aktivace“ BS buněk ve druhém kroku. Za normálních okolností BS buňky typické C 3 rostliny nejsou fotosynteticky aktivní. Kromě toho je počet jejích buněčných organel nízký, protože fotosyntéza probíhá v mezofylu. V důsledku anatomických změn ve směru C 4 fotosyntézy se BS buňky zvětšují a mají větší počet buněčných organel, které jsou spojeny se zvýšenou fotosyntetickou aktivitou (více chloroplastů) a se zvyšujícími se fotorespiračními efekty také tvoří více mitochondrií a peroxizomů.
Metabolismus C 2 (fotorespirační pumpa CO 2 )

Třetím krokem ve směru C 4 je vytvoření C 2 fotosyntézy (viz také část výše). Pro tvorbu C 2 fotosyntézy je nutné snížit aktivitu GDC v M buňkách nebo ji úplně vypnout. To se obvykle provádí deaktivací jedné ze čtyř podjednotek. V polní morikandii ( Moricandia arvensis ) bylo ukázáno, že v M buňkách chybí podjednotka P komplexu GDC. Výsledkem je, že komplex GDC je tam neaktivní. U předchůdce C 3 Moricandia moricandioides se naopak funkční komplexy GDC nacházejí v buňkách M i BS. Obecně platí, že geny pro všech podjednotek GDC v C 2 rostlinách jsou čteny specificky nebo alespoň s výhodou BS buňkách. S tvorbou C 2 fotosyntézy pravděpodobně postupovala diferenciace BS buněk dále (další nárůst počtu organel). Posun aktivity GDC k BS je považován za klíčový krok ve vývoji C 4 . Navíc v tomto vývojovém stavu by fotorespirace již nebyla obecnou nevýhodou, protože v jejím průběhu představuje glycin transportovaný do buněk BS zde důležitý zdroj CO 2 . Další úpravy (více organel v BS buňkách, optimalizace anatomie listů) by proto využití tohoto vnitřního zdroje CO 2 ještě zvýšilo .
Kromě fotorespirační pumpy CO 2 by dalším krokem ve směru fotosyntézy C 4 mohl být zvýšený výskyt karboanhydrázy (CA) a PEPC v cytosolu M buněk. U Flaveria bidentis byla původní izoforma transportována do chloroplastů, ale díky mutaci v tranzitním proteinu zůstává v cytosolu. CA a PEPC hrají klíčovou roli při předběžné fixaci CO 2 . Dalším prospěšným vedlejším účinkem je, že je snazší zachytit uvolněný CO 2 ze sousedních BS buněk. U fotosyntézy C 4 je aktivita dalších enzymů zapojených do metabolické dráhy, jako je např. B. dekarboxylační malátový enzym NAD (P) -ME se stále více přesouvá do BS buněk. Na oplátku se PPDK, který regeneruje PEP z pyruvátu, musí vyskytovat více v chloroplastech M buněk. Některé rostliny C 2 ve skutečnosti vykazují zvýšenou aktivitu těchto enzymů ve srovnání s jinými rostlinami C 2 a C 3 (faktor 2-5)-v čistých rostlinách C 4 se faktor pohybuje kolem 10-50.
Stanovení cesty C4 dikarboxylové kyseliny a optimalizace
V poslední fázi vývoje do rostlin C4 je aktivita RuBisCO M buněk snížena, protože jinak budou PEPC a RuBisCO soutěžit o substrát CO 2 . V závěrečné fázi navíc proběhnou další optimalizace. Enzymy se dále rozdělují do skupin, přizpůsobuje se světelná reakce fotosyntézy, aktivita karboanhydrázy v M buňkách se výrazně zvyšuje a podporuje se buněčně specifická genová exprese v BS a M. Například pro enzym PPDK je modifikace genového promotoru považována za důležitý krok pro evoluci C4 , protože to znamená, že gen pro PPDK se čte specificky v M buňkách.
Regulace a kinetika některých enzymů, jako je PEPC, musí být optimalizována. Vysoká koncentrace v mezofylové buňce je nezbytná pro difúzi malátu do BS buněk. Protože však malát také inhibuje „původní“ PEPC, musí být citlivost C4 -PEPC na malát snížena.
Protože mnoho metabolitů je transportováno mezi dvěma sousedními buňkami, tvorba C 4 fotosyntézy také vyžaduje nezbytnou transportní kapacitu. To vše umožňuje účinný transport CO 2 z mezofylové buňky do buňky pouzdra svazku.
Přeměna C 4 zpět na C 3 fotosyntézu
Evoluční rekonverze C 4 na původní C 3 fotosyntézu nebyla dosud prokázána. Jedním z možných důvodů by bylo, že to vyžaduje alespoň tolik evolučních kroků jako obrácená cesta, ale již to neslibuje výhodu výběru. Důvodem je, že takto transformovaná rostlina C 3 by měla pouze výhodu oproti rostlinám C 4 na stanovištích, kde již dominují jiné rostliny C 3 . Ve srovnání se současným C 3 se tehdy -Mitbewerbern nemohl etablovat.
webové odkazy
- Axel Brennicke: Evoluce C 4 fotosyntézy: Jak mírně upravené cesty C 4 by mohly vzniknout téměř 50krát paralelně. In: BiuZ. 6/2011, s. 362-363.
- Herfried Kutzelnigg: Evoluce rostlin C 4 . In: Studium Integrale Journal. Svazek 15 / 1. vydání - duben 2008, přístup 28. října 2014.
literatura
Zkontrolujte články a obecné informace
- Agepati S. Raghavendra Rowan F. Sage (Eds.): C 4 fotosyntézu a související CO 2 úpravného mechanismy . Springer, Dordrecht 2011, ISBN 978-90-481-9406-3 (řada Pokroky ve fotosyntéze a dýchání, svazek 32).
- Oula Ghannoum: C 4 fotosyntéza a vodní stres . In: Annals of Botany 103 (4), 2009, s. 635-644, PMID 18552367 , PMC 2707343 (volný plný text, PDF).
- Donat-Peter Häder : Fotosyntéza . 1. vydání, Thieme Verlag, Stuttgart 1999. ISBN 978-3-13-115021-9 .
- Hans W. Heldt a Birgit Piechulla: Biochemie rostlin . 4. vydání. Spektrum Akademischer Verlag, 2008, ISBN 978-3-8274-1961-3 , s. 211 ff .
- Ulrich Lüttge , Manfred Kluge a Gerhard Thiel: Botanika - komplexní biologie rostlin . 1. vydání, Wiley-VCH Verlag GmbH & Co. KGaA; Weinheim 2010; ISBN 978-3-527-32030-1 .
- Lincoln Taiz (autor), Eduardo Zeiger (autor) a B. Jarosch (překladatel): fyziologie rostlin: originál s překladatelskými pomůckami. 4. vydání, Spektrum Akademischer Verlag; Heidelberg 2007; ISBN 978-3-8274-1865-4 .
vývoj
- Rowan F. Sage: Portrét fotosyntetické rodiny C4 k 50. výročí jejího objevu: počet druhů, evoluční linie a síň slávy . In: Journal of Experimental Botany . páska 68 , č. 2 , 2017, s. e11 - e28 , doi : 10,1093 / jxb / erx005 , PMID 28110278 .
- RF Sage a Stata, M. (2014): Fotosyntetická rozmanitost se setkává s biodiverzitou: Příklad rostliny C 4 . In: J Plant Physiol . pii: S0176-1617 (14) 00236-3; PMID 25264020 ; doi: 10.1016 / j.jplph.2014.07.024 .
- PA Christin a Osborne, CP. (2013): Rekurentní sestava C 4 fotosyntézy, evoluční příběh. In: Photosynth Res . 117 (1-3); Pp. 163-175; PMID 23703454 ; doi: 10,1007 / s11120-013-9852-z .
- RF Sage, TL Sage a Kocacinar, F. (2012): Fotorespirace a evoluce C 4 fotosyntézy . In: Annu Rev Plant Biol . 63; Pp. 19-47; PMID 22404472 ; doi: 10,1146 / annurev-arplant-042811-105511 .
- U. Gowik a Westhoff, P. (2011): Cesta od C 3 do C 4 fotosyntézy. In: Plant Physiol. 155 (1); Pp. 56-63; PMID 20940348 ; doi: 10,1104 / str.110.165308 .
Individuální důkazy
- ↑ a b c d e f g h i j k l Rowan F. Sage: Portrét fotosyntetické rodiny C4 k 50. výročí jejího objevu: počet druhů, evoluční linie a síň slávy . In: Journal of Experimental Botany . páska 68 , č. 2 , 2017, s. e11 - e28 , doi : 10,1093 / jxb / erx005 , PMID 28110278 .
- ↑ a b c Andreas Bresinsky a další: Strasburger - učebnice botaniky. 36. vydání. Akademické nakladatelství Spectrum; Heidelberg 2008; ISBN 978-3-8274-1455-7 , s. 312.
- ↑ Hans W. Heldt, Birgit Piechulla: Biochemie rostlin . 4. vydání. Akademické nakladatelství Spectrum, Heidelberg 2008; ISBN 978-3-8274-1961-3 , s. 226.
- ↑ a b c d Peter Raven, Ray F. Evert, Susan Eichhorn: Biologie rostlin . 4. vydání. de Gruyter, Berlín / New York 2006, ISBN 3-11-018531-8 , s. 154 .
- ^ Andreas Bresinsky a další: Strasburger - učebnice botaniky. 36. vydání. Akademické nakladatelství Spectrum; Heidelberg 2008; ISBN 978-3-8274-1455-7 , s. 311.
- ^ A b c Rowan F. Sage, Ferit Kocacinar, David S. Kubien: C 4 fotosyntéza a teplota . V: Raghavendra, Sage (Ed.): C, 4 fotosyntézy a související CO 2 úpravného mechanismy. 2011, s. 161-195.
- ↑ Sophie NR Young, Lawren Sack, Margaret J Sporck-Koehler, Marjorie R Lundgren: Proč je fotosyntéza C4 na stromech tak vzácná? In: Journal of Experimental Botany . páska 71 , č. 16. , 6. srpna 2020, s. 4629-4638 , doi : 10,1093 / jxb / eraa234 , PMID 32409834 , PMC 7410182 (volný plný text).
- ↑ WJ Bond, FI Woodward, GF Midgley,: Globální distribuce ekosystémů ve světě bez ohně . In: Nový fytolog . 165, č. 2, 2005, s. 525-538. doi : 10.1111 / j.1469-8137.2004.01252.x . PMID 15720663 .
- ↑ Elizabeth A. Kellogg: C4 fotosyntéza . In: Aktuální biologie . 23, č. 14, srpen, s. R594-R599. doi : 10,1016 / j.cub.2013.04.066 .
- ↑ Dietmar Brandes: Šíří se rostliny C 4 ve střední Evropě? , Série pro vegetační studia 27 - Sukopp -Festschrift, 1995, s. 365–372.
- ↑ a b c d Robert T. Furbank: Chůze po cestě C 4: minulost, přítomnost a budoucnost . In: J Exp Bot . 67, č. 14, červenec 2016, s. 4057-4066. doi : 10,1093 / jxb / erw161 . PMID 27059273 .
- ↑ Hodge, AJ, McLean, JD. a Mercer, FV.: Ultrastruktura lamel a grana v chloroplastech Zea mays . In: J Biophys Biochem Cytol. . 1, č. 6, listopad 1955, s. 605-614. PMID 19866553 . PMC 2223833 (plný text zdarma).
- ↑ a b Hatch, MD. (2002): C 4 fotosyntéza: objev a rozlišení. In: Photosynth Res. 73 (1-3); Pp. 251-256; PMID 16245128 ; doi: 10,1023 / A: 1020471718805 .
- ↑ Kortschak, HP., Hartt, CE. a Burr, GO.: Fixace oxidu uhličitého v listech cukrové třtiny . In: Plant Physiol. . 40, č. 2, březen 1965, s. 209-213. PMID 16656075 .
- ↑ Osmond, CB.: Beta-karboxylace během fotosyntézy v Atriplexu . In: Biochim Biophys Acta. . 141, č. 1, červen 1967, s. 197-199. doi : 10,1016 / 0304-4165 (67) 90264-4 . PMID 6069308 .
- ↑ Hatch, MD. (1971): Mechanismus a funkce fotosyntézy C4 . In: MD Hatch, CB Osmond and Slatyer RO (eds): Photosynthesis and Photorespiration . Wiley-Interscience, New York, s. 139-152.
- ↑ a b c d e f g h i j k l m n U. Gowik a Westhoff, P. (2011): The path from C 3 to C 4 photosynthesis. In: Plant Physiol. 155 (1); Pp. 56-63; PMID 20940348 ; doi: 10,1104 / str.110.165308 .
- ↑ Peter Schopfer a Axel Brennicke: fyziologie rostlin . 7. vydání. Akademické nakladatelství Spectrum; Heidelberg 2010; ISBN 978-3-8274-2351-1 ; S. 281.
- ↑ Kořenový gen podporuje fotosyntézu , flora research.de , přístup 28. října 2014.
- ↑ a b Andreas Bresinsky a další: Strasburger - učebnice botaniky. 36. vydání. Akademické nakladatelství Spectrum; Heidelberg 2008; ISBN 978-3-8274-1455-7 , s. 308.
- ↑ a b Ulrich Lüttge, Manfred Kluge a Gerhard Thiel: Botanika - komplexní biologie rostlin . 1. vydání, Wiley-VCH Verlag GmbH & Co. KGaA; Weinheim 2010; ISBN 978-3-527-32030-1 ; Pp. 776-777.
- ↑ a b Donat-Peter Häder: Fotosyntéza. 1. vydání, Thieme Verlag, Stuttgart 1999, ISBN 978-3-13-115021-9 , s. 205.
- ↑ a b c Andrea Bräutigam a Andreas PM Weber: Transportní procesy: Propojení reakcí C 4 fotosyntézy: In: Agepati S. Raghavendra, Rowan F. Sage (Ed.): C 4 fotosyntéza a související koncentrační mechanismy CO 2 . Springer, Dordrecht 2011, ISBN 978-90-481-9406-3 (řada Pokroky ve fotosyntéze a dýchání, svazek 32).
- ↑ a b c Hans W. Heldt, Birgit Piechulla: Biochemie rostlin . 4. vydání. Akademické nakladatelství Spectrum, Heidelberg 2008; ISBN 978-3-8274-1961-3 , s. 217 a násl.
- ↑ Donat-Peter Häder: Fotosyntéza. 1. vydání, Thieme Verlag, Stuttgart 1999, ISBN 978-3-13-115021-9 , s. 210.
- ↑ a b c d e Gerald E. Edwards, Elena V. Voznesenskaya: C 4 Fotosyntéza: Kranzovy formy a jednobuněčný C 4 v suchozemských rostlinách. V: Agepati S. Raghavendra Rowan F. Sage (Ed.): C, 4 fotosyntézy a související CO 2 úpravného mechanismy . Springer, Dordrecht 2011, ISBN 978-90-481-9406-3 ( Pokroky v sérii fotosyntézy a dýchání, svazek 32), s. 29-61.
- ↑ Hans W. Heldt, Birgit Piechulla: Biochemie rostlin . 4. vydání. Akademické nakladatelství Spectrum, Heidelberg 2008; ISBN 978-3-8274-1961-3 , s. 220.
- ↑ Donat-Peter Häder: Fotosyntéza. 1. vydání, Thieme Verlag, Stuttgart 1999, ISBN 978-3-13-115021-9 , s. 207.
- ↑ a b c d e f g h i j k l R. F. Sage, TL Sage and Kocacinar, F. (2012): Photorespiration and the evolution of C 4 photosynthesis . In: Annu Rev Plant Biol . 63; Pp. 19-47; PMID 22404472 ; doi: 10,1146 / annurev-arplant-042811-105511 .
- ↑ Hans W. Heldt, Birgit Piechulla: Biochemie rostlin . 4. vydání. Akademické nakladatelství Spectrum, Heidelberg 2008; ISBN 978-3-8274-1961-3 , s. 224-225.
- ↑ a b Chris J. Chastain: Struktura, funkce a posttranslační regulace C4 pyruvát ortofosfát dikinázy . V: Agepati S. Raghavendra (eds.), A Rowan F. Sage (Eds.): C 4 Fotosyntéza a příbuzné CO 2 Koncentrované mechanismy (Advances in fotosyntézy a dýchání). Springer Nizozemsko 2011; ISBN 978-90-481-9406-3 ; 301-315.
- ↑ a b Chris J. Chastain a kol. (2011): Funkční vývoj C 4 pyruvátu, ortofosfát dikinázy . In: J Exp Bot 62; Pp. 3083-3091; doi: 10,1093 / jxb / err058 .
- ↑ H. Akhani. a kol. (2012): Nový druh Bienertia (Chenopodiaceae) z íránských solných pouští: třetí druh rodu a objev čtvrté suchozemské rostliny C4 bez Kranzovy anatomie . In: Plant Biosystems 146: 550-559; doi: 10,1080 / 11263504.2012.662921 .
- ↑ George Bowes: Jednobuněčná C 4 fotosyntéza ve vodních rostlinách. V: Raghavendra, Sage (Ed.): C, 4 fotosyntézy a související CO 2 úpravného mechanismy. 2011, s. 63-80.
- ↑ P. Wang, D. Vlad a Langdale JA (2016): Nalezení genů pro vybudování rýže C4. Curr Opin Plant Biol. 31; 44-50. doi: 10,1016 / j.pbi.2016.03.012 ; PMID 27055266
- ↑ Hans Lambers, F. Stuart Chapin III. a Thijs L. Pons: Fyziologická ekologie rostlin . 2. vydání, Springer, Berlín 2008; ISBN 978-0-387-78340-6 ; S. 80.
- ↑ Šalvěj, RF. (2002): Jsou metabolismus kyseliny crassulacean a fotosyntéza C4 nekompatibilní? In: Funkční biologie rostlin 29 (6); Pp. 775-785; doi: 10,1071 / PP01217 .
- ↑ Stanislav Kopřiva: dusík a síra Metabolismus v C 4 Rostliny v: Agepati S. Raghavendra Rowan F. Sage (eds.): C 4 fotosyntézy a související CO 2 úpravného mechanismy . Springer, Dordrecht 2011, ISBN 978-90-481-9406-3 (řada Pokroky ve fotosyntéze a dýchání, svazek 32).
- ↑ Ulrich Lüttge, Manfred Kluge a Gerhard Thiel: Botanika - komplexní biologie rostlin . 1. vydání, Wiley-VCH Verlag GmbH & Co. KGaA; Weinheim 2010; ISBN 978-3-527-32030-1 ; Pp. 781-782.
- ↑ Roxana Khoshravesh, Matt Stata, Florian A. Busch, Montserrat Saladié, Joanne M. Castelli: Evoluční původ fotosyntézy C4 v subtribu Grass Neurachninae . In: fyziologie rostlin . páska 182 , č. 1 , leden 2020, s. 566-583 , doi : 10,1104 / str. 19,00925 , PMID 31611421 , PMC 6945869 (volný plný text).
- ↑ a b c Rowan F. Sage a kol.: Někteří to mají rádi: fyziologickou ekologii evoluce rostlin C4 . In: Oecologia . páska 187 , č. 4 , 2018, s. 941-966 , doi : 10,1007 / s00442-018-4191-6 , PMID 29955992 .
- ↑ a b Ulrich Lüttge, Manfred Kluge a Gerhard Thiel: Botanika - komplexní biologie rostlin . 1. vydání, Wiley-VCH Verlag GmbH & Co. KGaA; Weinheim 2010; ISBN 978-3-527-32030-1 ; Pp. 785-786.
- ↑ a b Michael B. Jones: C 4 druhy jako energetické plodiny . V: Raghavendra, Sage (Ed.): C, 4 fotosyntézy a související CO 2 úpravného mechanismy . 2011, s. 379-397.
- ↑ Lincoln Taiz (autor), Eduardo Zeiger (autor) a B. Jarosch (překladatel): fyziologie rostlin: originál s překladatelskými pomůckami. 4. vydání, Spektrum Akademischer Verlag; Heidelberg 2007; ISBN 978-3-8274-1865-4 , s. 215.
- ↑ Peter Raven, Ray F. Evert, Susan Eichhorn: Biologie rostlin . 4. vydání. de Gruyter, Berlín / New York 2006, ISBN 3-11-018531-8 , s. 823 .
- ↑ Kerstin Stolzenburg: Výsledky testů vrby, topoly a miscanthus z LAP Forchheim. (PDF; 348 kB) 14. prosince 2006, archiv z originálu 11. prosince 2014 ; přístup 8. srpna 2016 .
- ↑ Donat-Peter Häder: Fotosyntéza. 1. vydání, Thieme Verlag, Stuttgart 1999, ISBN 978-3-13-115021-9 , s. 214.
- ^ B James N. Burnell: překážkami pro strojírenství větší fotosyntézy u kulturních rostlin: C 4 rýže . V: Raghavendra, Sage (Ed.): C, 4 fotosyntézy a související CO 2 úpravného mechanismy . 2011, s. 361-378.
- ↑ Webové stránky projektu C4 rýže ( Memento v originálu od 3. února 2017 do internetového archivu ) Info: archiv odkaz se automaticky vloží a dosud nebyl zkontrolován. Zkontrolujte původní a archivační odkaz podle pokynů a poté toto oznámení odeberte. , přístup 3. února 2017
- ↑ a b c P. A. Christin a Osborne, CP. (2013): Rekurentní sestava C 4 fotosyntézy, evoluční příběh. In: Photosynth Res . 117 (1-3); Pp. 163-175; PMID 23703454 ; doi: 10,1007 / s11120-013-9852-z .
- ↑ Hans W. Heldt, Birgit Piechulla: Biochemie rostlin . 4. vydání. Akademické nakladatelství Spectrum, Heidelberg 2008; ISBN 978-3-8274-1961-3 , s. 225.
- ↑ Lincoln Taiz (autor), Eduardo Zeiger (autor) a B. Jarosch (překladatel): fyziologie rostlin: originál s překladatelskými pomůckami. 4. vydání, Spektrum Akademischer Verlag; Heidelberg 2007; ISBN 978-3-8274-1865-4 , s. 216-217.
- ↑ Lincoln Taiz (autor), Eduardo Zeiger (autor) a B. Jarosch (překladatel): fyziologie rostlin: originál s překladatelskými pomůckami. 4. vydání, Spektrum Akademischer Verlag; Heidelberg 2007; ISBN 978-3-8274-1865-4 , s. 217.
- ↑ Peter Schopfer a Axel Brennicke : fyziologie rostlin . 7. vydání, Spektrum Akademischer Verlag; Heidelberg 2010; ISBN 978-3-8274-2351-1 , s. 295.
- ^ Andreas Bresinsky a další: Strasburger - učebnice botaniky. 36. vydání. Akademické nakladatelství Spectrum; Heidelberg 2008; ISBN 978-3-8274-1455-7 , s. 1012.
- ↑ Ulrich Lüttge, Manfred Kluge, Gabriela Bauer: Botanika . 5. zcela revidováno Edice. Wiley-VCH, Weinheim 2005; ISBN 978-3-527-31179-8 ; S. 485.
- ↑ Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Biochemie rostlin . Garland Pub, New York, NY 2008, ISBN 978-0-8153-4121-5 ; S. 136.
- ↑ Rowan F. Sage: Vývoj fotosyntézy C4 . In: Nový fytolog . 161, č. 2, 1. února 2004, ISSN 1469-8137 , s. 341-370. doi : 10.1111 / j.1469-8137.2004.00974.x .
- ↑ a b R. F. Sage a Stata, M. (2014): Fotosyntetická rozmanitost se setkává s biodiverzitou: Příklad rostliny C4 . In: J Plant Physiol . pii: S0176-1617 (14) 00236-3; PMID 25264020 ; doi: 10.1016 / j.jplph.2014.07.024 .
- ↑ a b c Jens Boenigk: Biodiverzita a historie Země. Springer-Verlag, 2015, ISBN 978-3-642-55389-9 , s. 144.
- ↑ a b Ulrich Lüttge, Manfred Kluge a Gerhard Thiel: Botanika - komplexní biologie rostlin . 1. vydání, Wiley-VCH Verlag GmbH & Co. KGaA; Weinheim 2010; ISBN 978-3-527-32030-1 ; S. 797.
- ^ PA Christin. a kol. (2011): C 4 eudicoty nejsou mladší než C 4 monocots In: J. Exp. Bot. 62 (9): s. 3171-3181; doi: 10,1093 / jxb / err041 .
- ↑ a b c Hans Konrad Biesalski: Mikronutrienty jako motor evoluce. Springer-Verlag, 2015, ISBN 978-3-642-55397-4 , s. 63.
- ^ EJ Edwards, SA Smith: Fylogenetické analýzy odhalují stinnou historii trav C4. In: Sborník Národní akademie věd . Svazek 107, číslo 6, únor 2010, s. 2532-2537, doi: 10,1073 / pnas.0909672107 , PMID 20142480 , PMC 2823882 (volný plný text).
- ↑ Colin P. Osborne: Geologická historie rostlin C 4 . V: Raghavendra, Sage (Ed.): C, 4 fotosyntézy a související CO 2 úpravného mechanismy . 2011, s. 339-357.